Cell子刊:柳光宇/江一舟/龚悦团队揭示三阴性乳腺癌免疫逃逸新机制,并提出潜在治疗策略
原创 生物世界
编辑丨王多鱼
排版丨水成文
三阴性乳腺癌(TNBC)有着转移率高、预后差、患者生存率低等特征,是最具侵袭性和最致命的乳腺癌亚型,其缺乏雌激素受体(ER)和孕激素受体(PR),以及人表皮生长因子受体2(HER2)这几个乳腺癌治疗靶点,也因此得名。
虽然三阴性乳腺癌(TNBC)的预后在当前的免疫治疗时代得到了显著改善,但许多TNBC患者对免疫治疗产生抵抗,疾病进展迅速。解析调控抗肿瘤免疫的代谢机制将为TNBC的治疗策略提供新思路。
2024年11月7日,复旦大学附属肿瘤医院柳光宇、江一舟、龚悦等人在 Cell 子刊 Med 上发表了题为:DHDH-mediated D-xylose metabolism induces immune evasion in triple-negative breast cancer 的研究论文。
研究团队对复旦大学上海肿瘤中心三阴性乳腺癌(FUSCC TNBC)多组学数据进行生物信息分析,发现了与低免疫浸润相关的关键代谢酶二氢二醇脱氢酶(DHDH),并进一步揭示了其促进肿瘤免疫逃逸的机制。
该研究还发现,在体内补充D-木糖(DHDH的底物)促进了CD8+T细胞浸润和细胞毒性标志物的表达,并增加了DHDH过表达的肿瘤对免疫检查点阻断疗法(ICB)的敏感性。
这一发现为在DHDH高表达的三阴性乳腺癌(TNBC)患者中将D-木糖或富含木糖的饮食(例如高纤维膳食)与免疫治疗联合,提供了理论支持。

在这项最新研究中,研究团队对复旦大学上海肿瘤中心三阴性乳腺癌(FUSCC TNBC)多组学数据库进行了生物信息学分析,确定了一种关键代谢酶——二氢二醇脱氢酶(DHDH),可能促进了TNBC的“冷肿瘤”表型,并进一步通过体内外功能实验验证DHDH的生物学功能,探索了DHDH促进TNBC免疫逃逸的潜在分子机制。
从机制上来说,DHDH介导了底物D-木糖(D-xylose)的合成和消耗,并抑制PSMB9蛋白的活化和进一步诱导免疫应答。证明了D-木糖可以增强CD8+T细胞的增殖和对共培养的DHDH-野生型细胞的细胞毒性标志物的表达。在体内补充D-木糖促进了CD8+T细胞浸润和细胞毒性标志物的表达,并增加了DHDH过表达的肿瘤对免疫检查点阻断疗法(ICB)的敏感性。
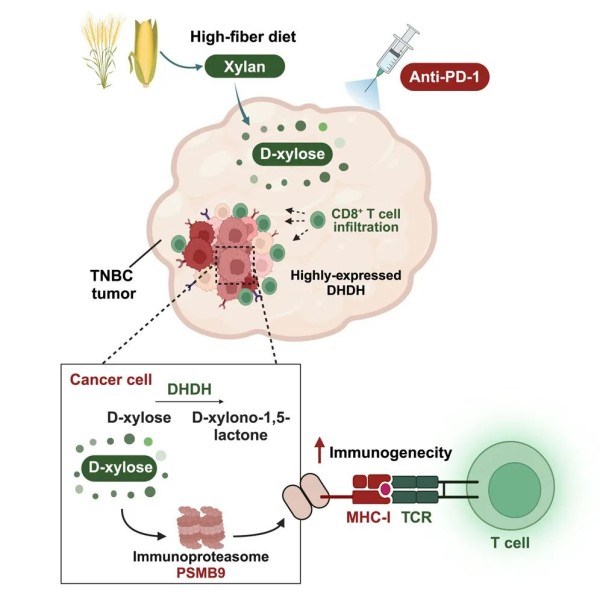
这些研究结果表明,D-木糖调节的PSMB9依赖性通路控制着肿瘤的固有免疫原性,因此也控制着对免疫检查点阻断疗法(ICB)的敏感性,这可能为促进三阴性乳腺癌(TNBC)的“由冷向热”转变提供了新方法。
论文链接:
https://www.cell.com/med/abstract/S2666-6340(24)00410-0

阅读原文
网址:Cell子刊:柳光宇/江一舟/龚悦团队揭示三阴性乳腺癌免疫逃逸新机制,并提出潜在治疗策略 https://mxgxt.com/news/view/875274
相关内容
柳光宇:为乳腺癌患者重塑“完整”人生这种乳腺癌很凶猛!肿瘤专家:别担心,试试这种新疗法!
我国专家提出鼻咽癌免疫治疗新方案
专访:柳光宇:为乳腺癌患者重塑“完整”人生
mRNA疗法:肿瘤免疫治疗的新曙光?
歌手姚贝娜乳癌复发病逝!如何避免乳腺癌复发?
世界乳腺癌防治月|豆制品吃多了会得乳腺癌吗?专家表示:乳腺癌防治误区,你占了几条?
再发高水平文章!武汉大学李红良团队揭示肝脏脂质调控新机制
关爱女性健康关注乳腺癌防治
我国科研团队提出人工合成细菌治疗肿瘤新方法

