编码包含人IgG1的经修饰的Fc区和至少一种异源抗原的多肽的核酸的制作方法
编码包含人igg1的经修饰的fc区和至少一种异源抗原的多肽的核酸
1.本发明涉及核酸和由那些核酸编码的肽。特别地,所述肽包含经修饰的igg1 fc区和一个或多个异源表位,其可为b-细胞表位或t-细胞表位。本发明的核酸和肽可用作刺激高亲合力cd8 t细胞、th1 cd4 t-细胞和强烈抗体应答的疫苗。对于癌症疫苗,至关重要的是刺激包括cd4和cd8 t细胞应答在内的强效细胞免疫。对于传染性疾病疫苗,重要的是刺激细胞免疫和中和抗体。
2.免疫系统是可用于对抗有害病原体和恶性肿瘤的强大防御机制。特别是适应性免疫系统可通过疫苗接种来训练以靶向恶性疾病所特有的改变、突变或过表达的自体抗原和入侵的外来病原体(如,病毒)。
3.免疫系统可以识别并消除癌细胞的概念被称为免疫监视[1,2]。癌症和自身之间的免疫学差异可被天然检测到,并导致许多个体中癌细胞的消除。该理论表明,免疫系统天然能够检测并消除癌细胞。在免疫活性小鼠中的研究显示,肿瘤的排斥和所获得的保护可通过转移t细胞过继转移至小鼠[3]。小鼠敲除模型显示,干扰素γ(ifnγ)和淋巴细胞对降低致癌物诱导的肉瘤和自发性上皮癌的发病率很重要[4]。患有自发性消退性黑色素瘤的患者显示肿瘤特异性克隆t细胞扩增的迹象,提供了免疫监视的证据[5]。最近的工作表明,在转化过程中由肿瘤引起的突变可产生能够被t细胞有效靶向的新抗原[6]。这项工作都强调了这样的事实:免疫系统能够区分肿瘤和自身,但是在许多免疫健康的个体中仍然发生癌症。这是由于肿瘤的高突变频率,其可导致免疫平衡,在这种免疫平衡的情况下,肿瘤避免原始免疫应答,但免疫应答可适应且仍攻击肿瘤。最终,尽管免疫应答,肿瘤仍在被称为“免疫编辑”的过程中逃逸并生长[7]。
[0004]
免疫疗法寻求将免疫细胞募集到肿瘤微环境中并增强抗肿瘤免疫。有两个主要原因可以阻止这种情况的发生。首先,肿瘤没有提供正确的环境条件来引发(prime)有效的免疫应答。在缺乏由诸如toll样受体(tlr)或损伤相关分子模式分子(damps)的信号诱导的共刺激来刺激危险或充分呈递肿瘤特异性表位来引发应答的情况下,不产生能够进行肿瘤裂解的高亲合力t细胞[8,9]。刺激不能杀死肿瘤细胞的低亲合力t细胞被认为是许多早期肿瘤疫苗失败的原因。解决t细胞引发缺乏并诱导肿瘤特异性免疫应答的策略包括疫苗。有效的抗癌免疫疗法依赖于可被高亲合力t细胞识别的抗原的有效靶向。在肿瘤上表达的许多抗原也在正常组织上表达,并且识别它们的t细胞经历胸腺耐受。这留下了众多的低亲合力t细胞,这些t细胞可被高剂量的免疫原刺激,但从未观察到足够地靶向肿瘤细胞来杀死它们。目标是发现非胸腺表达且在肿瘤细胞上以高丰度存在而在健康组织中不存在的抗原。
[0005]
病毒可被大体分类为“无包膜的”或“有包膜的”。在功能上,病毒包膜能够使病毒进入其宿主。包膜表面上的病毒糖蛋白识别并结合宿主细胞膜上的受体位点。这导致病毒包膜与宿主的膜融合,进入并释放病毒基因组,以及感染宿主。在病毒感染早期,产生cd4和cd8 t细胞应答来定位并杀死病毒感染的细胞,从而阻止病毒的进一步复制。随后的感染中,产生病毒中和抗体(vnab)来帮助防止再感染。记忆t细胞应答和vnab的组合在预防对相同或相关病毒的新感染中都是重要的。同样的现象也适用于其他病原体感染。疫苗需要在
暴露于病毒/病原体之前刺激免疫应答,并且将疫苗设计为使宿主能够快速应答且有效地去除低病毒载量并防止与病毒相关的任何发病。因此,疫苗需要刺激识别低抗原载量的高亲合力t细胞和防止病毒进入细胞的中和抗体。t细胞可识别病毒蛋白,因为它们都会在受感染细胞的细胞表面的环境mhc中呈递。然而,中和抗体需要与病毒蛋白结合,这些病毒蛋白接触宿主细胞上的受体并允许它们进入细胞。最有效的病毒疫苗是刺激强效t细胞和抗体应答但与低发病率相关的减毒病毒。已经有几种获得许可的减毒病毒疫苗,包括天花、麻疹和脊髓灰质炎。然而,许多病毒已进化为逃避免疫识别,因而不适合作为减毒病毒疫苗。这可通过使用灭活的病毒来克服,病毒的灭活使用化学物质如甲醛或热灭活来实现。这类疫苗可刺激抗体应答,但是需要大量的病毒/病原体,并且在刺激高亲合力t细胞应答方面很差。类似的方法是使用病毒样颗粒,其组装且看起来像病毒,但不能复制。同样,这些疫苗诱导强烈抗体应答,并且已获得预防hpv感染的许可。减毒病毒的替代物是使用杂合病毒。对诸如麻疹或腺病毒的病毒进行遗传修饰以由异源病毒产生蛋白质。使这些病毒弱化或丧失能力,使得它们不能致病;它们仍可在细胞内复制,或它们已缺失了基因使得它们不能复制。病毒载体往往具有良好的安全性,埃博拉病毒疫苗最近获得批准。然而,存在对病毒载体(麻疹,腺病毒)的任何预先存在的免疫力可能影响它们的有效性并限制加强减弱的免疫应答的能力。它们也可仅用于单一病毒,因为一旦建立了对载体病毒的免疫应答,它们就不能用作新病毒的载体。病毒疫苗的优势在于它们可产生高水平的蛋白表达,诱导强烈抗体应答。这也可使用蛋白疫苗来实现。然而,蛋白疫苗还需要佐剂以模拟强效免疫应答;此外,经常需要多剂量。蛋白和异源病毒疫苗都产生高水平的抗原,但是这刺激低亲合力t细胞应答,这样仅杀死具有高病毒载量的细胞,这很危险,因为这些细胞可能在低亲合力t细胞有时间反应之前就被病毒裂解,并且使大量病毒涌入宿主中。
[0006]
us7067110b1公开了fc-抗原融合蛋白的应用,其中将完整抗原或抗原结构域与抗体的铰链-ch2-ch3结构域融合,可增强抗体和细胞免疫。wo2002/058728公开了利用与抗原融合的人igg1 fc多肽靶向fcγri可刺激高亲合力t-细胞应答。wo2008/116937公开了包含非特异性启动子和至少一个编码免疫球蛋白分子的重组重链的序列的核酸,其中重链具有至少一个异源t细胞表位,使得核酸表达时重链不能呈现其天然构象。破坏一抗结构,抑制折叠和/或将分泌仅限于重链或非常少量的完整抗体,刺激强烈的辅助和抗原特异性t细胞应答。
[0007]
第一方面,本发明提供了一种编码多肽的核酸,所述多肽包含:
[0008]
(i)人igg1的经修饰的fc区,和
[0009]
(ii)至少一种异源抗原,
[0010]
其中与相应的野生型fc区相比,(a)所述经修饰的fc区至少包含能够结合cd64的fc部分,(b)所述经修饰的fc区的至少一个残基被修饰为来自小鼠igg3抗体的相应残基,并且(c)所述经修饰的fc区具有增强的对fc-γ受体(fcγr)的亲合力。
[0011]
第二方面,本发明提供了一种编码多肽的核酸,所述多肽包含:
[0012]
(i)人igg1的经修饰的fc区,和
[0013]
(ii)至少一种异源抗原,
[0014]
其中与相应的野生型fc区相比,(a)所述经修饰的fc区至少包含能够结合trim21的fc部分,(b)所述fc区的至少一个残基被修饰为来自小鼠igg3抗体的相应残基,并且(c)
所述经修饰的fc区具有增强的对fc-γ受体(fcγr)的亲合力。
[0015]
第三方面,本发明提供了一种编码多肽的核酸,所述多肽包含:
[0016]
(i)人igg1的经修饰的fc区,和
[0017]
(ii)至少一种异源抗原,
[0018]
其中与相应的野生型fc区相比,(a)所述经修饰的fc区至少包含能够结合cd64和/或trim21的fc部分,(b)所述fc区的至少一个残基被修饰为来自小鼠igg3抗体的相应残基,并且(c)所述经修饰的fc区具有增强的对fc-γ受体(fcγr)的亲合力。
[0019]
第四方面,本发明提供了包含第一方面的核酸的载体。
[0020]
第五方面,本发明提供了由第一方面的核酸或第二方面的载体编码的多肽。
[0021]
本发明人意外发现,将某些小鼠igg3(migg3)fc残基转移到抗原-fc融合蛋白的higg1fc区提高了该抗原的免疫原性。migg3是形成非共价低聚物的migg中唯一的同种型,强烈影响其生物学活性[10],并增强对多价抗原的功能性亲和力。认为邻近migg3 fc区之间的非共价相互作用通过延长靶标占用和降低解离率来加强这种增强的功能性亲和力[11,12]。grey等人[13]最初确定了migg3低聚化倾向,表明结合多价抗原促进migg3分子间相互作用,导致对抗原的功能性亲和力增强[14,15],这一特征被称为“分子间协同性”[12,15,16]。确定该现象取决于fc,因为igg3 f(ab’)2片段未与抗原协同结合[14]。在本发明中观测到改进的免疫原性是令人惊讶的,因为没有预期寡聚化higg1 fc与树突细胞上的fcγri结合。意外地,本发明人证明根据本发明的fc修饰改善了对异源抗原的细胞和体液应答。这表明增强的fcγri亲合力导致更有效的抗原呈递。此外,由于本发明的fc修饰多肽最初以单体形式结合,它不能与会导致抑制免疫应答的低亲和力fcriib和fcriiib抑制性受体结合。通过建立分子间协同结合而创造具有增强的免疫原性的改进疫苗,可导致优越的临床应用。
[0022]
与相应野生型人igg1 fc区相比,经修饰的fc区可具有增强至少约10%的对fc-γ受体(fcγr)的亲合力,优选对fcγri的亲合力。与相应野生型人igg1 fc区相比,经修饰的fc区可具有增强至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或至少约100%的对fc-γ受体(fcγr)的亲合力,优选对fcγri的亲合力。
[0023]
与包含未经修饰的野生型人igg1区和至少一种异源抗原的相应肽相比,本发明的多肽优选具有增强的免疫原性和/或非共价寡聚化。
[0024]
与包含未经修饰的野生型人igg1区和至少一种异源抗原的相应多肽相比,本发明的多肽的免疫原性和/或非共价寡聚化可增强至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或至少约100%。
[0025]
在本发明中,经修饰的fc区包含结合cd64和/或trim21的fc部分。经修饰的fc区可包含ch2和ch3,并且任选地还可包含铰链区。人igg1 ch2和/或ch3结构域的一个或多个残基可用来自小鼠igg3 ch2和/或ch3结构域的相应残基取代。在本发明的一些方面,fc区的至少一个残基选自ch2和/或ch3结构域。在一些方面,至少一个残基选自ch2结构域。在一些方面,至少一个残基选自ch3结构域。
[0026]
通过亚结构域分析剖析组合的ch2-ch3区揭示,通过转移包含migg3残基286-306和339-378的包含ch2和ch3元件的非连续区段(总共23个残基),可能增强人igg1的fc区对
fcγr的亲和力。这23个残基为:n286t、k288w、k290q、a339p、q342r、p343a、r344q、e345t、l351i、s354p、d356e、e357q、l358m、t359s、n361k、q362k、k370t、g371n、y373f、p374s、s375e、d376a、a378s。这些残基对于通过分子间协同性来增加非共价寡聚化是必须的,这是由于直接相互作用以及构象残基的联合作用,其中后者可能形成容许性(permissive)框架。fc区修饰的进一步详细说明在pct/ep2020/071724中描述,其内容通过引用全部并入。
[0027]
人igg1 fc区可具有对一个或多个以下fc区残基的修饰:n286、k288、k290、a339、q342、p343、r344、e345、l351、s354、d356、e357、l358、t359、n361、q362、k370、g371、y373、p374、s375、d376、a378。修饰可为以下中的一个或多个:n286t、k288w、k290q、a339p、q342r、p343a、r344q、e345t、l351i、s354p、d356e、e357q、l358m、t359s、n361k、q362k、k370t、g371n、y373f、p374s、s375e、d376a、a378s。
[0028]
人igg1的经修饰的fc区可包含选自以下位点的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23个残基处的修饰:n286、k288、k290、a339、q342、p343、r344、e345、l351、s354、d356、e357、l358、t359、n361、q362、k370、g371、y373、p374、s375、d376、a378。优选地,经修饰的igg1抗体fc区包含全部23个残基处的修饰。
[0029]
人igg1的经修饰的fc区可包含选自以下的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23个修饰:n286t、k288w、k290q、a339p、q342r、p343a、r344q、e345t、l351i、s354p、d356e、e357q、l358m、t359s、n361k、q362k、k370t、g371n、y373f、p374s、s375e、d376a、a378s。优选地,经修饰的igg1抗体fc区包含全部23个修饰。
[0030]
经修饰的fc区可包含对一个或多个以下fc区残基的修饰:n286、k288、k290、q342、p343、e345、l351、t359、n361、q362、g371、p374、s375、d376、a378。修饰可为以下中的一个或多个:n286t、k288w、k290q、q342r、p343a、e345t、l351i、t359s、n361k、q362k、g371n、p374s、s375e、d376a、a378s。
[0031]
经修饰的fc区可包含选自以下位点的1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个残基处的修饰:n286、k288、k290、q342、p343、e345、l351、t359、n361、q362、g371、p374、s375、d376、a378。优选地,经修饰的人igg1抗体fc区包含全部15个残基处的修饰。
[0032]
经修饰的fc区可包含选自以下的1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个修饰:n286t、k288w、k290q、q342r、p343a、e345t、l351i、t359s、n361k、q362k、g371n、p374s、s375e、d376a、a378s。优选地,经修饰的fc区包含全部15个修饰。
[0033]
经修饰的fc区可包含对一个或多个以下fc区残基的修饰:q342、p343、e345、n361、q362、p374、d376。所述修饰可以是q342r、p343a、e345t、n361k、q362k、p374s、d376a中的一个或多个。
[0034]
经修饰的fc区可包含选自以下位点的1、2、3、4、5、6或7个残基处的修饰:q342、p343、e345、n361、q362、p374、d376。优选地,经修饰的fc区包含全部7个残基处的修饰。
[0035]
经修饰的fc区可包含选自以下的1、2、3、4、5、6或7个修饰:q342r、p343a、e345t、n361k、q362k、p374s、d376a。优选地,经修饰的fc区包含全部7个修饰。
[0036]
经修饰的fc区可包含seq id no:1提供的氨基酸序列,或与seq id no:1具有至少90%同一性的氨基酸序列。seq id no:1是示例性经修饰的fc区的氨基酸序列“iv1”(参见表4)。
[0037]
本发明多肽的结构可具有抗体重链序列或其中的基本部分。免疫球蛋白结构域的
结构和位置可参考http://www.imgt.org/确定。
[0038]
整个说明书中,残基编号参考用于抗体序列编号的标准化imgt系统,如lefranc等人(2009)所公开[17]。其他合适的编号系统是本领域技术人员所熟知的。可将其他合适的编号系统用于识别经修饰的人igg1抗体
–
其抗原融合蛋白之间的相应残基。允许识别相应残基的任何编号系统均适用于本发明。本文所使用的编号系统并不限制本发明的范围,仅用于识别可被修饰的相关残基。术语“相应残基”意指在被比较的两个或更多个抗体或其抗原结合片段中在结构或功能上等同位置上的残基。在一些情况下,相应残基可通过序列比对来识别。在一些情况下,相应残基可通过结构比较来识别。
[0039]
在本发明的一些方面中,多肽可包含fc区的至少10个氨基酸残基、fc区的至少20个氨基酸残基、fc区的至少30个氨基酸残基、fc区的至少40个氨基酸残基、fc区的至少50个氨基酸残基、fc区的至少75个氨基酸残基、fc区的至少100个氨基酸残基、fc区的至少200个氨基酸残基、fc区的至少300个氨基酸残基、fc区的至少400个氨基酸残基、或fc区的至少500个氨基酸残基。优选地,多肽包含人igg1的整个fc区。
[0040]
至少一种异源抗原可(直接或通过接头)连接至人igg1的经修饰的fc区的n-端。如果至少一种异源抗原(直接或通过接头)连接至人igg1的经修饰的fc区的c-端,则是次优选的。异源抗原是多肽时,其可在异源抗原的n-端或更优选c-端连接至经修饰的fc区。异源抗原是相对大的分子,如病毒或细菌蛋白或其免疫原性片段时,可使用本发明多肽的这种形式。在优选的这种形式中,异源抗原的c-端任选通过接头连接至经修饰的fc区的n-端。
[0041]
在本发明的一些方面中,至少一种异源抗原包含选自图28至图33中任一个列出的表位中的一个或多个表位。
[0042]
在本发明的一些方面中,至少一种异源抗原包含选自表2或表3列出的表位中的一个或多个表位。
[0043]
在本发明的一些方面中,至少一种异源抗原包含选自以下的一个或多个表位:
[0044]
(a)gtgramlgthtmevtvyh(seq id no:29);
[0045]
(b)svydffvwl(seq id no:30);和
[0046]
(c)wnrqlypewteaqrld(seq id no:31)。
[0047]
在本发明的一些方面中,至少一种异源抗原包含选自以下的一个或多个表位:
[0048]
(a)gtgramlgthtmevtvyh(seq id no:29);
[0049]
(b)svydffvwl(seq id no:30);
[0050]
(c)wnrqlypewteaqrld(seq id no:31);和
[0051]
(d)vpldcvlyrygsfsvtldivqg(seq id no:32)。
[0052]
在本发明的一些方面中,至少一种异源抗原包含选自以下的一个或多个表位:
[0053]
(a)gtgramlgthtmevtvyh(seq id no:29);
[0054]
(b)svydffvwl(seq id no:30);
[0055]
(c)wnrqlypewteaqrld(seq id no:31);
[0056]
(d)vpldcvlyrygsfsvtldivqg(seq id no:32);
[0057]
(e)ancsvydffvwlhyysvrdtllgpgrpyr(seq id no:33);和
[0058]
(f)qctevradtrpwsgpyilrnqddrelwprkff(seq id no:34)。
[0059]
在本发明的一些方面中,至少一种异源抗原包含选自以下的一个或多个表位:
[0060]
(a)llmwitqcf(seq id no:35);
[0061]
(b)sllmwitqc(seq id no:36);
[0062]
(c)pesrllefylampfatpmeaelarrslaq(seq id no:37);和
[0063]
(d)pgvllkeftvsgniltirltaadhr(seq id no:38)。
[0064]
在本发明的一些方面中,至少一种异源抗原包含选自以下的一个或多个表位:
[0065]
(a)llmwitqcf(seq id no:35);
[0066]
(b)sllmwitqc(seq id no:36);
[0067]
(c)pesrllefylampfatpmeaelarrslaq(seq id no:37);
[0068]
(d)pesrllefy(seq id no:39);
[0069]
(e)rllefylampfatp(seq id no:40);
[0070]
(f)lefylampf(seq id no:41);
[0071]
(g)efylampfatpm(seq id no:42);
[0072]
(h)mpfatpmea(seq id no:43);
[0073]
(i)lampfatpm(seq id no:44);
[0074]
(j)llefylampfatpm(seq id no:45);
[0075]
(k)llefylampfatpmeaelarrslaq(seq id no:46);
[0076]
(l)pgvllkeftvsgniltirltaadhr(seq id no:38);
[0077]
(m)lkeftvsgniltirl(seq id no:47);
[0078]
(n)keftvsgnilt(seq id no:48);
[0079]
(o)keftvsgnilti(seq id no:49);
[0080]
(p)tvsgniltir(seq id no:50);和
[0081]
(q)tvsgnilti(seq id no:51)。
[0082]
在本发明的一些方面中,至少一种异源抗原包含选自以下的一个或多个表位:
[0083]
(a)kiadynykl(seq id no:52);
[0084]
(b)klpddftgcv(seq id no:53);
[0085]
(c)ellhapatv(seq id no:54);
[0086]
(d)cpfgevfnatrfasvtawnr(seq id no:55);
[0087]
(e)risncvadysvlynsasfst(seq id no:56);
[0088]
(f)ylyrlfrksnlkpferdi(seq id no:57);
[0089]
(g)yqpyrvvvlsfellhapatv(seq id no:58);
[0090]
(h)alntpkdhi(seq id no:59);
[0091]
(i)lqlpqgttl(seq id no:60);
[0092]
(j)llldrlnql(seq id no:61);
[0093]
(k)gmsrigmev(seq id no:62);
[0094]
(l)illnkhida(seq id no:63);
[0095]
(m)gnggdaalalllldrlnqle(seq id no:64);和
[0096]
(n)khwpqiaqfapsasaffgms(seq id no:65)。
[0097]
如本文所用,术语“免疫原性片段”是比整个抗原或蛋白更小且能够引起对宿主动物(例如人)中该片段的特异性体液免疫应答和/或细胞免疫应答的抗原或蛋白的一部分。
使用本领域已知的技术可产生蛋白片段,如通过蛋白水解消化重组或通过化学合成。多肽的内部片段或末端片段可通过从编码多肽的核酸的一端(对于末端片段)或两端(对于内部片段)去除一个或多个核苷酸来产生。
[0098]
接头序列通常是柔性的,因为它们主要由诸如甘氨酸、丙氨酸和丝氨酸的氨基酸组成,这些氨基酸不具有可能限制柔性的庞大侧链。可选择地,具有较大刚性的接头也是可取的。可以容易地确定接头序列的可用长度或最佳长度。通常接头序列的长度少于约12个氨基酸,如少于约10个氨基酸,或为2-10个氨基酸。接头的长度可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸。可使用的合适接头示例包括但不限于:ggggs(seq id no:106)、gggsg(seq id no:107)、ggsgg(seq id no:108)、gsggg(seq id no:109)、gsgggp(seq id no:110)、ggeps(seq id no:111)、ggegggp(seq id no:112)、ggegggsegggs(seq id no:113)和gggsgggg(seq id no:114)。其他接头可包括具有一个或多个以下序列基序的序列:gggs(seq id no:115)、tvlrt(seq id no:116)、tvssas(seq id no:117)和tvlssas(seq id no:118)。本发明中使用的优选接头是ig铰链。
[0099]
可选择地,本发明的多肽可包含抗体可变区,所述或每个异源抗原插入或替换到所述抗体可变区中。本发明的多肽可包含人igg1重链,所述人igg1重链包含其fc区中的修饰。如果所述或每个异源抗原替换到可变区的一个或多个cdr中,则是优选的。虽然全部cdr可用于异源抗原的替换,但是优选的cdr是cdr3。异源抗原是例如癌症抗原时,可使用本发明多肽的这种形式。
[0100]
可变抗体可以是重链可变区,所述重链可变区包含分别替换到cdr1、cdr2和cdr3中的以下异源抗原:
[0101]
(a)gtgramlgthtmevtvyh(seq id no:29),svydffvwl(seq id no:30)和vpldcvlyrygsfsvtldivqg(seq id no:32);或
[0102]
(b)llmwitqcf(seq id no:35),sllmwitqc(seq id no:36)和pesrllefylampfatpmeaelarrslaq(seq id no:37)。
[0103]
由本发明的核酸编码的多肽可包含seq id no:2或seq id no:3提供的氨基酸序列。seq id no:2和seq id no:3是分别由iscib1plus载体(参见图31)和iscib2载体(参见图33)编码的完整抗体重链的氨基酸序列。
[0104]
异源抗原可以是冠状病毒的n蛋白或其免疫原性片段。优选地,n蛋白来自sars-cov-2。例如,n蛋白可来自sars-cov-2谱系a武汉毒株、sars-cov-2变体b.1.351或sars-cov-2变体b.1.617.2。n蛋白可包含seq id no:4提供的氨基酸序列(武汉毒株)。n蛋白可包含seq id no:5提供的氨基酸序列(b.1.351变体)。n蛋白可包含seq id no:26提供的氨基酸序列(b.1.1.7变体)。
[0105]
优选地,由本发明的核酸编码的多肽包含seq id no:6提供的氨基酸序列。seq id no:6是n蛋白(武汉毒株)与经修饰的fc区iv1融合的氨基酸序列,由“sn15”载体编码(参见图27)。
[0106]
优选地,由本发明的核酸编码的多肽包含seq id no:7提供的氨基酸序列。seq id no:7是n蛋白(b.1.351变体)与经修饰的fc区iv1融合的氨基酸序列,由“sn17”载体编码(参见图48)。
[0107]
由本发明的核酸编码的多肽可包含seq id no:27提供的氨基酸序列。seq id no:27是n蛋白(b.1.1.7变体)与经修饰的fc区iv1融合的氨基酸序列,由“sn16”载体编码(参见图47)。
[0108]
本发明的核酸可与编码包含至少一种异源抗原的第二多肽的第二核酸组合(单独或连接)提供。第二多肽可以是抗体轻链。轻链可具有插入或替换到其中的一个或多个异源抗原。所述或每个异源抗原可替换到抗体轻链的一个或多个cdr中。虽然全部cdr可用于异源抗原的替换,但是优选的cdr是cdr3。
[0109]
由第二核酸编码的抗体轻链可包含以下分别替换到cdr1、cdr2和cdr3中的异源抗原 : wnrqlypewteaqrld (seq id no: 31) 、ancsvydffvwlhyysvrdtllgpgrpyr (seq id no: 33)和qctevradtrpwsgpyilrnqddrelwprkff(seq id no:34)。
[0110]
由第二核酸编码的抗体轻链可包含替换到cdr2中的序列pgvllkeftvsgniltirltaadhr(seq id no:38)。
[0111]
由第二核酸编码的抗体轻链可包含seq id no:10或seq id no:11提供的氨基酸序列。seq id no:10和11是分别由iscib1plus载体(图31)和iscib2载体(图33)编码的抗体轻链的氨基酸序列。
[0112]
优选地,由本发明的核酸编码的多肽包含seq id no:2提供的氨基酸序列,并且由第二核酸编码的抗体轻链包含seq id no:10提供的氨基酸序列。
[0113]
优选地,由核酸编码的多肽包含seq id no:3提供的氨基酸序列,并且由第二核酸编码的抗体轻链包含seq id no:11提供的氨基酸序列。
[0114]
在本发明的一些方面中,第二核酸编码sars-cov-2的受体结合结构域。受体结合结构域可包含seq id no:8提供的氨基酸序列(武汉毒株rbd)。受体结合结构域可包含seq id no:9提供的氨基酸序列(b.1.351变体rbd)。受体结合结构域可包含seq id no:28提供的氨基酸序列(b.1.1.7变体rbd)。
[0115]
优选地,由本发明的核酸编码的多肽包含seq id no:6提供的氨基酸序列,并且第二核酸编码包含seq id no:8提供的氨基酸序列的受体结合结构域。
[0116]
优选地,由核酸编码的多肽包含seq id no:7提供的氨基酸序列,并且第二核酸编码包含seq id no:9提供的氨基酸序列的受体结合结构域。
[0117]
由本发明的核酸编码的多肽可包含seq id no:27提供的氨基酸序列,并且第二核酸编码包含seq id no:28提供的氨基酸序列的受体结合结构域。
[0118]
由本发明的核酸编码的多肽可包含与上述序列中的任一个至少90%相同的氨基酸序列。例如,由本发明的核酸编码的多肽可包含与上述序列中的任一个至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的氨基酸序列。
[0119]
本发明提供分别由图27、28、29、30、31、32、33、2、3、4、5、6、7、8、9、10、11、12、13、14、15、47、48、54、55、56、57、58或59公开的氨基酸序列中的一个或两个。根据本发明优选的多肽在图12b(任选与图12a组合)、图13b(任选与图13a组合)、图14b(任选与图14a组合)、图15b(任选与图15a组合)、图27b(任选与图27a组合)、图29a(任选与图29b组合)、图31a(任选与图31b组合)和图33b(任选与图33a组合)列出。特别优选的序列在图27、31、33、48和54至59中公开。
[0120]
本发明人已证实,利用sn15(编码谱系a武汉毒株n蛋白和rbd)免疫,产生针对该毒株但同时与b.1.351和b.1.617.2变体rbd交叉反应的强vnab。类似地,本发明人已证实,利用sn17(编码b.1.351变体n蛋白和rbd)免疫,产生针对该毒株但同时与谱系a武汉毒株和b.1.617.2变体rbd交叉反应的强vnab。
[0121]
包含经修饰的fc区的本发明多肽和包含野生型fc区的相应多肽的亲合力可通过表面等离子体共振(如,biacore 3000/t200,ge healthcare)来测定,例如,通过将增加浓度的本发明多肽(0.3nmol/l至200nmol/l)注入包含合适配体(如,fcγri)的cm5芯片上并使用合适的软件(如,biaevaluation 4.1)将数据拟合至合适的结合模型。可使用相同条件对具有野生型fc区的相应多肽进行相应实验。在本发明的一些方面中,表面等离子体共振指示本发明多肽与配体包被的cm5芯片结合更紧密时,包含经修饰的fc区的本发明多肽对配体表现出比具有野生型fc区的相应多肽更强的功能性亲和力。如所述,配体可包含fc受体,特别是fcγ受体。所有fcγ受体(fcγr)属于免疫球蛋白超家族,并且是诱导调理(标记)微生物的吞噬作用最重要的fc受体。该家族包括几个成员:fcγri(cd64)、fcγriia(cd32)、fcγriib(cd32)、fcγriiia(cd16a)、fcγriiib(cd16b),这些成员由于它们的分子结构不同,抗体亲和力也不同。fcγri与igg的结合比fcγrii或fcγriii与igg的结合更强。fcγri还具有由三个免疫球蛋白(ig)-样结构域组成的细胞外部分,比fcγrii或fcγriii多一个结构域。该特征允许fcγri结合单一igg分子(或单体),但是所有fcγ受体都必须与免疫复合物中的多个igg分子结合才能被激活。在本发明的一些方面,优选的受体是fcγri(cd64)。在本发明的一些方面,优选的受体是trim21。在本发明的一些方面,本发明的多肽能够结合cd64和/或trim21。trim21是胞质抗体受体和e3泛素连接酶。它检测细胞内部的抗体并介导它们的快速蛋白酶体降解。如果将抗体在其可变区内修饰为表达t细胞表位或将异源抗原连接至fc并且经由可直接转导抗原呈递细胞的dna质粒施用,蛋白会在细胞内翻译并被trim21靶向。
[0122]
包被有抗-his抗体的biacore cm5芯片包含共价附着于金表面的羧甲基化葡聚糖。将分子经由胺基、硫醇基、醛基或羧基共价结合至传感器表面。可研究涉及小有机分子(如,候选药物)到大分子组装物或整个病毒的相互作用。高结合能力产生高应答,有利于捕获测定和涉及小分子的相互作用。高表面稳定性提供准确性和精确性,并且允许对同一表面的重复分析。其他合适的芯片是本领域技术人员已知的,并且表面等离子体共振方案可通过本领域已知的标准技术进行调整。
[0123]
可以确定根据本发明的多肽的免疫原性。多肽的改进特性可相对于不包含经修饰的fc区残基的相应多肽的相应特性来测量。由于改进的功能特性是相对量度,用于确定本发明多肽的免疫原性或任何其他功能特性的精确方法不影响该功能特性的相对变化。
[0124]
然而不希望受理论的束缚,本发明多肽提供增强的免疫原性的能力可以是结合细胞表面受体的经修饰的人igg1 fc的直接结果。本发明的多肽和/或核酸通常以药物组合物的形式施用,除核酸/多肽之外,所述药物组合物可包含至少一种成分。
[0125]
本发明的多肽包含至少一种异源抗原。如本文所用,“异源抗原”意指与经修饰的fc区异源的抗原。抗原可以是t细胞抗原或b细胞抗原。根据本发明的一些多肽包含t细胞抗原和b细胞抗原二者。抗原可包含于相对大的分子(如,病毒蛋白或细菌蛋白或其免疫原性片段)中。可选择地,抗原可以是组成抗原或抗原内表位的氨基酸序列。这样的抗原/表位示
例列于本文的表2和表3中。
[0126]
抗原可来自癌症或可来自传染性疾病。在一些方面,抗原来自癌症。在一些方面,抗原来自传染性疾病。抗原可刺激高亲合力cd8 t细胞、th1 cd4 t细胞和/或强烈抗体应答。当本发明用作癌症疫苗时,重要的是刺激包括cd4和cd8 t细胞应答的强效细胞免疫。当本发明用作传染性疾病疫苗时,重要的是刺激细胞免疫和中和抗体。
[0127]
可将本发明的多肽、核酸和载体用作抗病毒感染特别是抗冠状病毒感染的疫苗。冠状病毒(cov)是冠状病毒亚科(冠状病毒科;套式病毒目)的成员,分为四个属:α-冠状病毒(α-cov)、β-冠状病毒(β-cov)、γ-冠状病毒(γ-cov)和δ-冠状病毒(δ-cov)[18,19]。γ-cov和δ-cov通常感染鸟类,但是有些会导致哺乳动物感染。已知α-cov和β-cov病毒可在人类和动物中感染并致病。sars-cov(β-cov)、229e(α-cov)、hku1(β-cov)、nl63(α-cov)和oc43(β-cov)病毒均会导致人类感染[18],通常引起上呼吸道感染和一些相对轻微的症状[20]。β-cov是人类中最具致病性的病毒,该组还包括sars-cov-2、mers-cov和sars-cov[18,21,22];这些病毒都在21世纪爆发过。在这些冠状病毒中,sars-cov-2表明与sars-cov的同源性最高,显示79%遗传相似度[23]。sars-cov-2与蝙蝠冠状病毒ratg13最相似,具有98%相似度[24]。
[0128]
cov的基因组是具有5
′‑
帽结构和3
′‑
poly-a尾的单链正义rna(+ssrna)。rna病毒基因组长度通常小于10kb,而cov基因组在rna病毒中是已知最大的,大约30kb。将基因组病毒rna用作模板来直接翻译多蛋白1a/1ab,其编码非结构蛋白(nsp)以在双膜囊泡(dmv)中形成复制-转录复合物(rtc)[25]。然后通过rtc以不连续转录的方式合成一套嵌套的亚基因组rna(sgrna)[26]。亚基因组信使rna(mrna)具有共同5
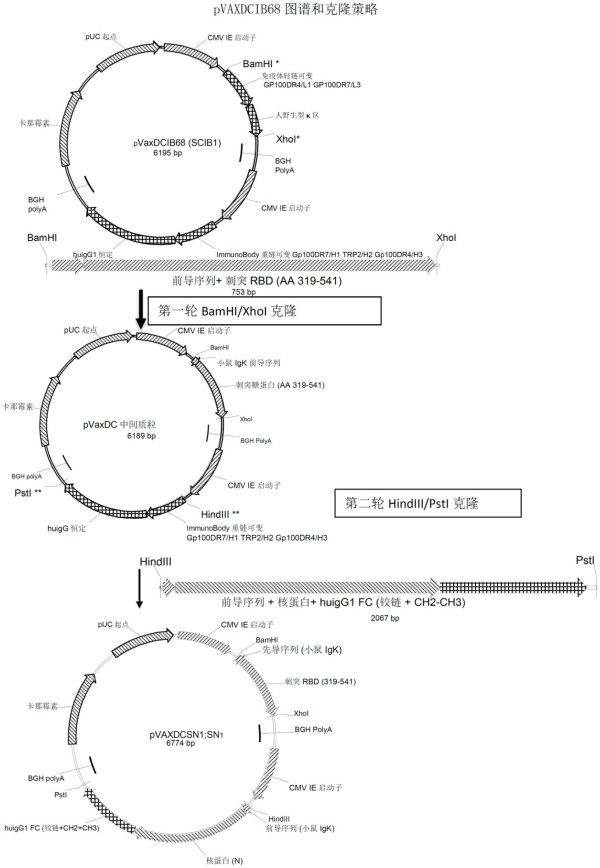
′‑
前导序列和3
′‑
末端序列。在位于开放读码框(orf)之间的转录调控序列处发生转录终止并随后获得前导rna。这些负链sgrna充当用于产生亚基因组mrna的模板[27,28]。典型的cov基因组和亚基因组包含至少六个orf。第一个orf(orf1a/b)约为整个基因组长度的三分之二,编码16个nsp(nsp1-16),基因组的其他orf在3
′‑
端附近,编码至少四个主要结构蛋白:刺突蛋白(s)、膜蛋白(m)、包膜蛋白(e)和核衣壳蛋白(n)。除了这四个主要结构蛋白,不同cov编码额外的特定结构和附属蛋白,如he蛋白、3a/b蛋白和4a/b蛋白。
[0129]
与其他引起呼吸道感染的冠状病毒一样,sars-cov-2主要通过呼吸道飞沫传播;与sars-cov和mers相比,sars-cov-2的传播率似乎更高。在一些人中,感染是无症状的,这些个体被认为是sars-cov-2感染的潜在来源[29],从而导致sars-cov-2的快速播散。在感染covid-19后发病的患者中,肺炎似乎是最常见的表现,其他症状还包括发烧、咳嗽、呼吸短促和胸片可见的双侧浸润[30]。
[0130]
一旦感染sars-cov-2,中位潜伏期为约4至5天,但症状出现可能在14天之后[31-34],其中97.5%的有症状患者在11.5天内出现症状[32]。病毒载量在症状出现后5至6天内达到峰值;这明显早于在症状出现后10天达到峰值的sars病毒[35-38]。在出现急性呼吸窘迫综合征的那些患者中,这种情况发生在症状开始后8至9天左右[30,39]。sars-cov-2引起侵袭性炎症应答,导致气道损伤[40],疾病的严重程度不仅取决于病毒感染,还取决于宿主的免疫应答。最常见的死亡原因是呼吸衰竭(70%的病例);此外,细胞因子的释放诱发细胞因子风暴效应,造成继发感染[41]和败血症,导致多器官衰竭和死亡。
[0131]
感染的第一步是病毒与宿主细胞通过其靶受体结合。sars-cov-2利用密集糖基化
的刺突(s)蛋白进入宿主细胞。s蛋白是以亚稳态融合前构象存在的三聚体i类融合蛋白,这种亚稳态融合前构象经历结构重排使病毒膜与宿主细胞膜融合[42,43];当s1亚基与宿主细胞受体结合时触发该过程。sars-cov-2病毒与血管紧张素转换酶2(ace2)受体结合[24];还报道了丝氨酸蛋白酶tmprss2在宿主细胞进入中起重要作用[44]。病毒靶向肺部的气道上皮细胞、血管内皮细胞和巨噬细胞,这些细胞均表达ace2[24,45]。s1亚基由氨基末端结构域和受体结合结构域(rbd)组成。rbd与触发sars-cov-2病毒体内吞作用的ace2结合并将其暴露于内体蛋白酶[46]。s2亚基由融合肽(fp)区和两个七肽重复区(hr1和hr2)组成[47,48]。在内体中,s1亚基被切割掉,暴露出融合肽,融合肽将自身插入宿主膜。然后s2区自身折叠使hr1和hr2区在一起。这导致膜融合并将病毒包装释放到宿主细胞质。
[0132]
一旦sars-cov-2病毒进入宿主细胞,病毒组装需要四个结构蛋白:s蛋白、m蛋白、e蛋白和n蛋白。s蛋白的同型三聚体组成病毒表面的刺突,它们负责附着于宿主受体[49,50],m蛋白使病毒粒成形并结合至n蛋白[51,52]。e蛋白在病毒组装和随后的释放中发挥作用,并且在疾病病理学中很重要[53,54]。n蛋白包含两个结构域,每个结构域可通过不同机制结合病毒rna基因组。据报道,n蛋白可结合nsp3蛋白以协助将基因组连接到复制转录复合体(rtc)并将封装的基因组包装到病毒粒中[20,55,56]。
[0133]
sars-cov和sars-cov-2的rbd具有72%同源的氨基酸序列和高度相似的三级蛋白结构。计算建模和生物物理学测量值表明,与来自sars-cov的rbd相比,sars-cov-2rbd与ace2结合具有更高的亲合力[57,58]。sars-cov-2s蛋白还包含与mers-cov和人冠状病毒oc43相似的弗林蛋白酶(furin)样切割位点,但是该切割位点在sars-cov中不存在[59]。这些特征很可能促进所观测到的sars-cov-2传染性增加并最终有助于病毒播散。
[0134]
大约80%的受sars-cov-2感染的个体没有症状或轻度感染[30],表明已建立有效的免疫。正如sars-cov和mers,大多数表现出严重症状的患者显示外周淋巴细胞减少的证据,这被认为是由于淋巴细胞从血液迁移到肺部感染的部位[60,61]。由cd4 t细胞响应病毒感染而产生的th1细胞因子如il-6、ifnγ、ip-10和mcp-1募集其他t细胞和单核细胞[60],并且在大多数情况下,将感染成功清除。然而,在一些情况下,感染进展并表现为更严重的肺部病理。这被认为是由于免疫应答功能失调和随后的细胞因子风暴效应,其中具有高水平的促炎细胞因子,包括il-2、il-7、il-10、g-csf、ip-10、mcp-1、mip-1α和tnfα[30,40,62],可能由巨噬细胞和升高的炎症性单核细胞水平介导。这种细胞因子风暴造成大部分相关的严重病理,但是至今不清楚持续的病毒感染对于驱动持续的免疫介导的损伤是否是需要的。
[0135]
关于对sars-cov-2的免疫应答的详细信息尚未收集到,但是可从sars-cov和mers中得到类比。已知sars-cov和mers都干扰i型和iii型ifn对病毒感染的应答,这又导致炎症性嗜中性粒细胞和巨噬细胞在感染部位增加[63,64]。很可能sars-cov-2也具有类似的免疫颠覆(immune subversion)机制。疾病严重性增加与嗜中性粒细胞增加和淋巴细胞减少相关[65,66]。在mers的情况下,巨噬细胞和dc的感染还可导致mhc i类和ii类的下调,这可导致感染部位的t细胞引发的显著降低[67]。目前尚不清楚sars-cov-2病毒是否会造成类似的影响,以及这是否导致病毒持续感染无法得到控制。
[0136]
严重sars-cov和mers病病例中外周t淋巴细胞的减少表明这些细胞在抗病毒免疫中的重要作用。一段时间以来,已知t细胞介导的免疫应答对于控制病毒感染至关重要
[68]。与严重疾病相关的t淋巴细胞减少也与cd4 t细胞的多功能性减少相关,特别是与产生ifnγ的那些相关[69]。不够理想的t-细胞应答与持续的抗原活化相结合可导致功能耗竭状态[70]。有趣的是,sars-cov-2患者显示疾病严重性与t细胞耗竭增加、功能多样性减少[71]和活化降低[72]相关,表明受损的t细胞应答可能部分地导致疾病进展和严重性。有可能这也许就是病毒或病毒驱动的t细胞耗竭引起的免疫颠覆作用。重症队列通常还以th2细胞因子(il-4、il-5和il-10)而不是th1细胞因子占优势为特征,这意味着极化至th1型应答是有益的[73]。th2细胞因子应答的存在还促进肺嗜酸性粒细胞浸润并使病理恶化[74]。在sars-cov感染中,强烈t细胞应答还与较高滴度的病毒中和抗体相关[73]。然而,目前的文献表明,尽管t细胞应答对于病毒清除至关重要,但需要当心不能加剧肺病理,因为感染部位的高t细胞水平也可能与重症相关[75]。使用鼠模型的许多报道表明,强烈th1应答以及病毒特异性cd8应答和病毒特异性中和抗体对于成功控制sars-cov和mers是必需的[76,77]。对于sars-cov-2也可能是同样的情况。在sars-cov感染的鼠模型中,已假设t细胞特别是cd4 t细胞对于控制感染是重要的。实际上,在小鼠模型中,cd4 t细胞的耗竭导致病毒持续感染延长和肺病理增加[78]。小鼠中的过继性t-细胞转移研究也显示了先前sars-cov特异性免疫在预防感染中的有益效果[79]。
[0137]
获得关于sars-cov-2存活者免疫应答的纵向数据还为时过早,但是来自恢复的sars-cov患者的证据表明,在感染后长达11年都存在对s抗原和n抗原的长期记忆t-细胞应答[80-82],这意味着β冠状病毒可能具有免疫记忆。小鼠模型也已证明,记忆cd8 t细胞应答有效地提供免受sars-cov感染的保护[76]。几种生物信息学方法已鉴定出sars-cov-2蛋白的潜在免疫原性区和可能的hla限制[83-86]。尽管至今尚未在sars-cov-2内定义t细胞表位,但已证实s、n和m病毒抗原也是cd4和cd8 t细胞介导的免疫的靶标([87]预印本)。grifoni等人鉴定了sars-cov-2患者中的应答,其中100%的患者对刺突蛋白、m蛋白和n蛋白显示共同优势cd4应答。主要观测到th1应答,这些强烈th1应答以及cd8应答与对s蛋白的抗体应答有很好的相关性。约70%的患者显示对s和m蛋白有优势cd8应答,但也观测到对所有其他抗原的应答。有趣的是,在grifoni等人的研究中,观测到其他人冠状病毒之间应答的交叉反应证据,因为40-60%的未暴露个体显示对所测试的sars-cov-2抗原的应答([87]预印本)。
[0138]
对sars和mers的研究表明,出现症状后2周时,80-100%的患者中可检测到病毒特异性抗体,但循环滴度通常是短暂的,在多年后大多数恢复的个体中逐渐下降且变得无法检出[88,89]。在sars-cov-2的情况下,急性抗病毒应答与症状恢复之前可在血液中可检测的抗体分泌细胞(asc)、滤泡辅助t细胞(t
fh
细胞)、活化的cd4+t细胞和cd8+t细胞以及sars-cov-2igm和igg抗体增加相关[90]。记忆b细胞以及t细胞应答促进长期保护,但是前者不容易维持且主要在次级淋巴组织中的循环和残基中检测到[76,88,91]。类似地,最近的分析抗体应答的动力学研究表明,大多数sars-cov-2患者(》95%)在发生疾病的19天内血清转化,并且在症状发作后的第一周结束时检测到抗体[89,92]。在出现症状后14天或更长时间可获得血清样品的一小队列的患者中,抗-n igg(n=15)的血清阳性率为94%,抗-n igm(n=14)的血清阳性率为88%,抗-rbd igg(n=16)的血清阳性率为100%,以及抗-rbd igm(n=15)的血清阳性率为94%。n和rbd的igg滴度与病毒中和滴度相关[93]。
[0139]
然而,在全球范围内,sars-cov-2抗体应答和其对疾病进展的影响仍然不清楚,如
报道所证实的,表明早期高血清igg抗体滴度与疾病严重性相关[94]。具体地,由于诱导ards(急性呼吸窘迫综合征),已将抗-s蛋白滴度的早期升高与更差的结果相关联,ards的特征在于经由抗体效应功能介导的途径使肺泡巨噬细胞极化为高度炎症性而非伤口愈合表型[95]。类似地,sars-cov-1期间,已显示快速但短暂的抗-s滴度和抗-n滴度与更差的结果相关[96]。恢复的患者在症状发作后平均20天显示滴度峰值,而死亡患者仅14.7天显示滴度峰值。
[0140]
最近的研究已表明,针对核衣壳蛋白的抗体可结合病毒裂解期间释放的n蛋白或在受感染细胞表面表达的n蛋白,并且免疫复合物可被抗原呈递细胞摄取,在抗原呈递细胞上trim21靶向细胞溶质降解的n蛋白并产生针对n肽的细胞毒性t细胞[97]。这是快速应答,在建立中和抗体之前介导病毒清除。这可以是含有与经修饰的fc连接的n-蛋白的疫苗的主要作用方法,由此经修饰的fc显示与trim21结合增强。此外,与表达相同rbd构建体但无n-fc的类似构建体相比,表达与经修饰的fc融合的n-蛋白的sn11产生对n-蛋白显著更好的t细胞应答,并且还产生对rbd、s1和肽rbd 417-425的更强应答。这表明,经修饰的n-fc起佐剂的作用并使apc活化,从而同样增强对其他抗原的t细胞应答。
[0141]
尽管非中和抗体可介导体内保护,但中和抗体最受关注[98]。例如,从接种并被攻毒的非人灵长类动物(nhp)的血清浓缩的多克隆igg能够保护幼稚nhp免受抗埃博拉病毒(ev)攻毒,并且早期研究表明抗体应答的发展与ev疾病的存活率有关[99,100],最后由regeneron开发出针对埃博拉病毒的三种单克隆抗体混合物。在sars/mers病毒生命周期中,中和抗体抑制病毒对接(rbd靶向),膜融合(s-蛋白靶向)或外脱(egress)(m-蛋白靶向)。重要的是,来自恢复期患者的抗体或血浆目前被评估作为covid-19患者可用的治疗选择之一——超过70%的从轻症covid-19恢复的患者具有在回访医院时持续存在的可测量的中和抗体——进一步证实sars-cov-2抗体应答在疾病解决中起作用的想法[101]。
[0142]
表面s糖蛋白是冠状病毒的主要抗原,是通过接合宿主受体并介导病毒-宿主膜融合而使病毒进入的关键。其他结构蛋白包括e蛋白、m蛋白和n蛋白,后者比其他结构蛋白先产生且更大量。利用编码所有四种蛋白的组合的vlp免疫兔子显示,与其他两种蛋白相比,s蛋白和n蛋白更具免疫原性,其中与s蛋白滴度相比,n蛋白滴度上升更快但更短暂[102]。sars-cov-2受体-结合结构域(rbd)最倾向于以与mers-cov和sars-cov-1rbd所示类似的方式引起强效中和反应[103]。这些事实表明,s1亚基中的rbd是抗体识别和中和的主要易受攻击(vulnerable)位点,其包括一系列构象表位,但这也是s蛋白的大多数天然存在的突变出现的区域[103-105]。因此,sars-cov-2血清抗体的交叉反应性分析显示,针对s蛋白的大多数抗体与sars-cov-1无交叉反应,而针对n蛋白的抗体确实显示一些交叉反应性。
[0143]
在罕见情况下,病原体特异性抗体可促进病理,导致被称为非固有的抗体依赖性增强(ade)的现象。ade已在包括寨卡(zika)病毒和登革(dengue)病毒的几种黄病毒以及呼吸道合胞病毒(rsv)的体外研究中得到了很好地表征[106]。该过程似乎受低质量和/或低数量非中和抗体支配,这些非中和抗体通过其fab结构域结合病毒颗粒,而其fc结构域接合单核细胞或巨噬细胞上表达的fc受体(fcr),从而促进病毒进入和感染。ade由不同免疫细胞(包括单核细胞、巨噬细胞和b细胞)上表达的fc受体(fcr)的接合介导,使得病毒细胞在不存在其典型受体或内体ph或蛋白酶的情况下能够进入。对于冠状病毒,先前研究已表明,利用灭活的完整sars-cov2免疫小鼠,利用mva编码的s蛋白免疫猕猴,以及利用编码全长s
蛋白的dna疫苗免疫小鼠,可在一定程度上诱导ade或嗜酸性粒细胞介导的免疫病理[95,107]。后一种现象似乎是由所产生的中和抗体质量以及短时抗体应答(滴度越快导致疾病越严重)的组合所驱动的,通过涉及将肺泡巨噬细胞从伤口愈合表型偏移到促炎表型(il-8产生)以及促炎单核细胞/巨噬细胞募集并积聚的机制;这一过程至少部分地由fcγ效应功能驱动[95]。
[0144]
建立针对病毒的预先存在的免疫对于在免疫应答变得失调之前消除病毒具有一定的价值。为了建立对sars-cov-2的群体免疫,我们需要允许“群体免疫”发展,或我们需要采用疫苗接种技术。这二者都依赖于建立长期记忆应答。已生产了用于动物的针对由冠状病毒引起的几种疾病的疫苗,包括用于禽类传染性支气管炎病毒、犬冠状病毒和猫冠状病毒(fcov)[108]。然而,疫苗增强疾病(ved)的可能性阻碍了针对呼吸道病毒(包括fcov)的疫苗的发展。与fcov中的ved相关的病理类似于在少部分患者中由covid-19引起的急性肺损伤。目前正在开发的covid-19疫苗集中于主要编码s蛋白并刺激vnab和t细胞应答的亚单位疫苗;仍然需要确定它们是否刺激持久的记忆应答或避免免疫病理。
[0145]
先前开发影响人类的冠状病毒科病毒的疫苗的项目针对sars和mers。在非人动物模型中测试了针对两种sars[109]和mers[110]的疫苗。目前尚无已显示在人类中安全有效的针对sars的治愈性或保护性疫苗[111]。
[0146]
根据目前的信息,通过疫苗接种刺激的免疫很可能需要包含强效病毒特异性cd8和cd4t细胞应答以及中和抗体应答二者。强效抗病毒t细胞应答的标志包括与多功能性结合的高功能亲合力。功能亲合力的调节涉及几个因素,例如细胞因子il-12和il-15[112,113]、cd8αβ表达[114-116]、tcr亲和力[117]、由抗原呈递细胞表达的共刺激分子水平[112,118]、以及dc的成熟状态。因此,挑战在于找到模拟这些条件的疫苗方法。大的免疫复合物可通过低亲和力的fcγriia(小鼠中的fcγriv)交叉呈递,但是仅在抑制性fcγriib受体被阻断或下调时[119]。因此,挑战在于制备靶向高亲和力fcγri且取代潜在占据血清igg的小遗传复合物。
[0147]
有效的疫苗策略必须证明:(i)能够防止在独立突发事件期间出现的异源病毒变体——值得注意的是,许多s-靶向抗体针对异源刺突糖蛋白具有显著降低的中和滴度;(ii)能够在难以免疫且sars-cov2诱导的发病率和死亡率的风险增加的老年人群中诱发稳固的免疫应答;以及(iii)避免不利的疫苗结果,例如利用sars n蛋白进行疫苗接种后显示疫苗诱导的免疫病理[120]。策略通常针对诱发中和抗体,这是证实与体内保护相关的;然而,这可能以仅覆盖窄范围的病毒反应性(即,非广泛中和)为代价。结合病毒更保守部分的抗体往往中和更低(在体外测定中),而依赖于fcr接合来提供体内保护,但可涵盖更广泛的保护范围。尽管与rbd相比携带更多的抗原决定簇,但是ade的风险阻碍了使用完整s蛋白[107]。在结构上,与sars-cov-1类似,sars-cov-2rbd暴露于s蛋白三聚体的两种已知状态,即闭合状态和开放状态,在闭合状态中每个rbd对称地接触其在另一原聚体上的类似物,在开放状态中至少一个rbd结构域延伸接触ace2。rbd也更容易产生并生成更高水平的中和抗体,其中大部分针对构象表位且不一定与ace2结合位点相关[104,105]。
[0148]
根据本发明的某些多肽、核酸和载体旨在诱导针对rbd的高亲和力抗体,因为已表明具有更强中和能力的更高亲和力的抗体携带降低的ade风险[107]。同时,与s或m蛋白相比,n蛋白是最早表达的蛋白且更大量[89]。结合其更保守的性质因而更有可能进行异源保
护,这也成为本发明的有效靶标。
[0149]
本发明可靶向s蛋白关键rbd以及病毒n蛋白以产生cd8 t细胞、cd4 t细胞和vnab。s蛋白在与ace2相互作用时以三聚体呈现,以便优化诱导具有中和表型的抗体。本发明人使rbd多聚化,并且这可用于预防或治疗sars-cov-2的疫苗中。
[0150]
本发明的一种多肽包含与经修饰的人igg3 fc区融合的n蛋白或其免疫原性片段。n蛋白或其免疫原性片段可包含氨基酸2-419或138-146。经修饰的人igg3 fc区可包含具有本文所述的鼠igg3修饰的铰链-ch2-ch3区。在图12b中示出了一个示例。该多肽可与包含rbd或其免疫原性片段的第二多肽组合。rbd可包含氨基酸319-541或330-525(登录号yp_009724390)。rbd可以(a)单独,(b)例如通过甘氨酸丝氨酸接头连接到三聚结构域如次要纤维蛋白三聚体折叠(fibritin trimer fold on)基序或二硫桥基序,或(c)在框内与(i)huigg1恒定结构域的铰链-ch2-ch3结构域(登录号p01857)或(ii)根据本发明的变体铰链-ch2-ch3 iv1融合。这些示例显示在本文的表4中。
[0151]
除了传染性疾病,例如病毒感染(如上所述)和细菌感染,本发明可用于靶向肿瘤抗原。这类抗原的示例列于本文的表3中。
[0152]
肿瘤积累了驱动生长和转移的突变。这些突变代表避免胸腺选择的独特表位。它们被称为“新表位”并且对个体肿瘤是特异的且在正常组织上未发现[121]。lennerz等在来自一位长期存活的黑色素瘤患者的混合淋巴细胞-肿瘤细胞培养物中鉴定出对8种抗原的应答,其中5种是新抗原[122]。这是表明新抗原与长期存活者中的应答有关的早期研究。这使得研究人员开发针对已鉴定的新表位的个性化疫苗。并非所有突变都刺激t细胞应答,但在突变频率和与呈递t细胞表位的可能性之间存在相关性。实际上,具有较高突变率的肿瘤的患者通常对检查点阻断疗法表现出更好的应答,表明内源性新表位应答被检查点阻断揭示[123]。由于大多数突变不刺激免疫应答,选择最合适的靶向表位可能是困难的。然而,在适当选择候选表位方面正在取得显著进展[124]。
[0153]
在人黑色素瘤中,已将质谱法用于直接从原发性肿瘤鉴定新表位,导致鉴定了许多潜在的靶标[125]。靶向这些新表位的疗法正在被转化到临床且显示特异性免疫应答的有效诱导[126-128]。几个组已用靶向多种新表位的疫苗治疗患者。sahin等人表明,在利用结内递送rna多表位疫苗进行治疗后,可在患者中产生多种新表位特异性应答[127]。他们证实了转移事件的降低和持续的无进展生存期。ott等人还利用肽多表位疫苗联合佐剂hiltonol(使聚ic与聚-l-赖氨酸双链rna稳定)治疗了6名黑色素瘤患者。他们观察到有效的新表位特异性t细胞应答,同时复发率降低[128]。此外,疫苗接种后复发疾病的患者在随后的抗程序性细胞死亡(pd-1)治疗后显示完全消退,这与新表位特异性t细胞应答的扩张有关。有趣的是,在这些研究中鉴定的新表位均被cd8和cd4 t细胞识别,表明人中除了cd8应答之外,cd4 t细胞应答的重要作用。这证实了由kreiter等人在小鼠模型中获得的先前数据[129]。靶向新抗原的一个缺点是它们昂贵,因为它们是患者特异性的且在肿瘤样品内和同一患者的肿瘤之间都可能存在巨大的变异性;这会导致不再表达突变的肿瘤生长[130]。为了克服在肿瘤发生过程中关键的“驱动力(driver)”突变(如,brafv600e)和其他常见突变,可以特异性地靶向它们;然而,这些是比较罕见的,且并不总是刺激t细胞应答。
[0154]
在发育过程中,对自身抗原特异的高亲合力t细胞在胸腺中通常缺失,留下众多的低亲合力部分。因此,显示有限的正常表达的抗原很可能担当更好的靶标,因为它们可能没
有经受相同程度的耐受性。在消退癌症患者中对自身抗原特异的t细胞的检测表明胸腺耐受并不总是完全的。消退癌症患者主要应答在正常组织中具有受限表达的抗原,例如分化抗原trp-2和癌症睾丸抗原ny-eso-1[131,132]。包括ny-eso-1的肿瘤相关抗原(taa)[131,133]和黑色素瘤抗原mage-1[134]为免疫应答提供了良好靶标,表明它们具有颠覆的免疫耐受性。
[0155]
一旦选择了合适的抗原,重要的是考虑如何最好地将其呈递给免疫系统。t细胞的刺激需要通过专业的抗原呈递细胞(apc)如树突细胞(dc)连同适当的活化共刺激信号加工并呈递抗原。活化共刺激信号包括由tlr配体提供的那些[综述于135中]。检查肽疫苗直接与tlr配体连接的临床前研究开始显示出前景。这些被认为更有效地将表位和tlr靶向dc,导致增加的dc成熟和共刺激分子的表达,细胞因子和趋化因子的分泌,以及在dc内形成抗原贮库,以允许长期的肽呈递[136,137]。除了直接连接之外,研究调查了与装配成纳米结构的tlr配体组合的两亲性肽的使用,并且在临床前研究中显示出前景[138,139]。同样重要的是考虑疫苗提供的抗原剂量。低剂量可足以选择出最高亲和力t细胞受体(tcr),从而选择高亲合力cd8 t细胞[140],但可能不足以刺激其表位靶标显示较低亲和力mhc-ii结合的cd4t细胞。
[0156]
广泛认可的是,高频率t细胞应答的产生不一定是诱导有效免疫应答的指示。从先前公开的工作显而易见的是,t细胞功能亲合力是临床应答的更好指标[141-145]。术语功能亲合力经常与亲和力混淆。亲和力通常被归类为肽mhc分子对t细胞受体(tcr)的结合强度的度量,而功能亲合力是通过tcr、共刺激分子、粘附分子和细胞因子刺激的组合的度量,其指示t细胞与靶标及其功能结果之间的相互作用的总强度[146]。在病毒感染模型和肿瘤模型中,仅高亲合力细胞毒性t淋巴细胞(ctl)介导病毒清除和肿瘤根除[117,141,143,147,148]。在体内产生免疫应答期间,ctl在克隆和多克隆水平上均显示出一系列功能亲合力。尽管已表明亲合力在病毒环境和肿瘤环境中都很重要,但是体内产生高和低亲合力ctl的机制仍然不清楚,因为tcr不能经历体细胞超突变。已在体外证明,在高剂量或低剂量抗原存在下培养tcr转基因ctl分别导致低和高亲合力应答的极化[141,143]。
[0157]
在早期研究中,编码肿瘤表位的肽疫苗在动物模型中显示出前景,刺激小鼠中特异性t细胞应答和肿瘤治疗。将这些肽疫苗转化到临床中不太成功,其中应答短暂且临床效力极低。早期疫苗集中于利用短肽(《15个氨基酸)刺激cd8 t细胞应答。然而,最近的研究集中于利用可刺激两种cd4和cd8 t细胞应答的较长肽序列,以避免先前使用较短肽序列所见的耐受性问题[149]。较长肽序列开始在临床研究中显示有前景的结果[150,151]。编码新表位的肽也开始显示具有检测到稳固的免疫应答的一定潜力和总体存活率提高的证据[152,153]。ott等人(2017)的研究表明,在利用与tlr3配体hiltonol混合的20种长肽进行疫苗接种之后新表位特异性应答增强[128]。
[0158]
合成肽也被用作基于dc的疫苗的一部分。已进行了许多研究,其中用肽、蛋白或肿瘤裂解物脉冲体外培养的dc。这些已在临床前研究中显示刺激有效免疫应答[综述于154中]。尽管刺激免疫应答,dc疫苗在临床上显示出有限的效力。至今唯一批准的基于治疗性自体细胞的疫苗sipuleucel-t显示3个月的适度存活益处,但是生产成本和时间严重限制了其应用[155]。这是大多数基于dc和自体细胞的疫苗的主要限制因素。此外,结合新表位肽的dc疫苗显示有前景的现有和从头合成新表位特异性应答扩张[126]。未成
熟dc的使用会影响它们的免疫原性并导致耐受性诱导,因此需要密切监测所使用dc的活化状态。制造基于dc的疫苗的粗放式培养方法(extensive culture method)也会影响它们的体内免疫原性。最近集中于dc亚群的离体分离且极少体外操作的工作已显示出有前景的结果[156]。
[0159]
本发明的核酸可以是dna、cdna或rna如mrna,通过克隆获得或者完全或部分通过化学合成产生。对于治疗用途,核酸优选以能够在待治疗的对象中表达的形式。本发明的核酸可以是重组的或者以分离和/或纯化形式作为分离物提供。除了可能有一个或多个用于表达的调控序列外,它可以不含或基本上不含人基因组中的基因两侧的核酸。根据本发明的核酸包括rna时,提及本文所示序列应解释为提及rna等价物,其中u替换t。
[0160]
考虑到可获得核酸序列和克隆,本发明的核酸可由本领域技术人员容易地制备,例如使用本文中包含的信息和参考文献和本领域已知的技术(例如,参见sambrook等人(1989)[157]和ausubel等人(1992)[158])。这些技术包括(i)使用聚合酶链式反应(pcr)扩增例如基因组来源的这种核酸的样品,(ii)化学合成,或(iii)制备cdna序列。编码多肽的dna可以本领域技术人员已知的任何合适的方式产生和使用,包括通过采用编码dna,鉴定待表达部分任一侧合适的限制酶识别位点,以及从dna中下出所述部分。然后将该部分可操作地连接到标准可商购表达系统中的合适启动子。另一种重组方法是利用合适的pcr引物扩增dna的相关部分。可对序列进行修饰,例如使用位点定向突变,导致表达经修饰的肽,或针对表达核酸的宿主细胞考虑密码子偏好。
[0161]
为了获得核酸序列的表达,可将序列并入载体中,所述载体具有一个或多个可操作地连接至该核酸来控制其表达的控制序列。载体可包含其他序列,如驱动所插入核酸表达的启动子或增强子,使多肽作为融合物产生的核酸序列,和/或编码分泌信号使宿主细胞中产生的多肽从细胞分泌的核酸。如果需要,可通过以下获得多肽:将载体转化至宿主细胞(载体在其中是功能性的),培养宿主细胞以使多肽产生,以及从宿主细胞或周围培养基回收多肽。本领域原核细胞和真核细胞用于此目的,包括大肠杆菌菌株、酵母菌株,以及真核细胞,如昆虫细胞和动物细胞,例如cos、cho细胞、bowes黑色素瘤细胞和其他合适的人细胞。本发明涉及编码抗体的重链和轻链的核酸时,各核酸可存在于同一表达载体中(由同一启动子或不同启动子驱动),或存在于单独的表达载体中。
[0162]
可将本发明的核酸用于在患者(如,哺乳动物,包括人)中刺激针对至少一种异源抗原的免疫应答。可刺激辅助和/或细胞毒性t细胞应答。针对本发明获得的特定表位的t细胞应答的亲合力可以高于通过利用作为简单肽的相同表位进行免疫所获得的亲合力或通过利用作为肽或核酸的在康院内编码的相同表位进行免疫所获得的亲合力。本发明的核酸可作为联合疗法(即,编码轻链的核酸和编码重链的核酸)施用。核酸可以静脉内、皮内、肌内、口服或通过其他途径施用。皮内或肌内施用是优选的,因为这些组织含有树突细胞。
[0163]
本发明的另一方面提供了包含本发明的核酸的载体。可将载体用于表达核酸以获得本发明的多肽,或可将它们本身用作治疗(如,疫苗)。
[0164]
示例性载体包括iscib1plus(参见图31)、iscib2(参见图33)、sn15(参见图27)和sn17(参见图48)。
[0165]
本发明的载体可包含以下提供的核苷酸序列:
[0166]
(a)seq id no:12和seq id no:13;或
[0167]
(b)seq id no:14和seq id no:15。
[0168]
seq id no:12和seq id no:13分别是完整iscib1plus重链和轻链表达盒的核苷酸序列,这两个序列均包括cmv启动子和bgh polya信号。seq id no:14和seq id no:15分别是完整iscib2重链和轻链表达盒的核苷酸序列,这两个序列均包括cmv启动子和bgh polya信号。
[0169]
本发明的载体可包含seq id no:16和seq id no:17提供的核苷酸序列。
[0170]
seq id no:16和seq id no:17分别是完整sn15 n蛋白-fc和s蛋白表达盒的核苷酸序列,这两个序列都包括cmv启动子和bgh polya信号。
[0171]
本发明的载体可包含seq id no:18和seq id no:19。
[0172]
seq id no:18和seq id no:19分别是完整sn17 n蛋白-fc和s蛋白表达盒的核苷酸序列,这两个序列都包括cmv启动子和bgh polya信号。
[0173]
本发明的载体可包含seq id no:20、seq id no:21或seq id no:22。优选地,本发明的载体由seq id no:20、seq id no:21或seq id no:22提供的核苷酸序列组成。
[0174]
seq id no:20是质粒形式的完整iscib1plus核苷酸序列。seq id no:21是doggybone(dbdna)形式的完整iscib1plus核苷酸序列。seq id no:22是质粒形式的完整iscib2核苷酸序列。
[0175]
本发明的载体可包含seq id no:23。优选地,本发明的载体由seq id no:23提供的核苷酸序列组成。seq id no:23是质粒形式的完整sn15载体核苷酸序列。
[0176]
本发明的载体可包含seq id no:24或seq id no:25提供的核苷酸序列。优选地,本发明的载体由seq id no:24或seq id no:25提供的核苷酸序列组成。seq id no:24是质粒形式的完整sn17载体核苷酸序列。seq id no:25是doggybone(dbdna)形式的完整sn17载体核苷酸序列。
[0177]
本发明的载体可以是dna。质粒dna疫苗提供了优于其他疫苗形式的优势,因为它们具有固有的佐剂活性,导致大量炎症细胞募集到免疫部位。dna疫苗诱导免疫的机制复杂且尚未完全阐明,但被认为涉及由apc表达的混杂和区别性dna传感器(表1)。cpg基序通过tlr9发信号来促进dc活化和成熟[159]。有趣的是,在tlr9敲除小鼠中仍观测到dna疫苗活性,这涉及介导佐剂活性的其他内体和胞质dna传感器[160]。dna传感器如tbk-1和sting激活tlr非依赖性途径并诱导i型干扰素[161]。最近,在髓样树突细胞中鉴定出解旋酶ddx41作为新的dna传感器[162]。此外,rig-1还可通过感测与rna聚合酶iii相关的胞质dna来刺激i型ifn[163]。ifn调节因子dna依赖性激活剂(dai/dlm-1/zbp1)是胞质dna传感器和先天免疫激活剂[164]。
[0178]
表1.提供强大佐剂性的dna传感器
[0179]
核酸dna传感器参考文献cpgtlr9[159]dsdnasting/tbk1[161]dsdnaddx41[162]dna/rna聚合酶iiirig-1[163]胞质dnadai[164]胞质dnaaim2[160]
胞质dnaifi16[165]cpg,dsdnahmgb-1[166]
[0180]
hmgb-1已作为核酸介导的诱导先天免疫应答的混杂传感器出现[166]。hmgb-1(染色质结合蛋白)根据其亚细胞和细胞外定位、氧化还原态以及与其他细胞表面受体的相互作用而具有一系列功能。作为细胞内复合物,hmgb-1相关的核酸通过tlr和胞质介导的传感器刺激i型ifn,激活促炎细胞因子并诱导炎性体(尽管是aim2)(综述于[160]中)。hmgb-1的细胞外释放具有一系列后果,包括维持肿瘤细胞自噬(通过与bcl-2竞争beclin-1结合以及免疫细胞的募集和活化[167])。最近,已显示hmgb-1的不同氧化还原态在hmgb-1活性中起重要作用[167]。hmgb-1在位置c23、c45、hc106处含有三个可被修饰的半胱氨酸。hmgb-1的还原的全硫醇形式是介导白细胞募集的化学引诱物。二硫化物形式具有细胞因子(但不是趋化因子)活性。由活性氧物质诱导的hmgb-1的完全氧化形式是无活性的。hmgb-1还与细胞因子和其他免疫受体形成复合物,其他免疫受体包括rage、tlr4、tlr2、cd24、tim-3、血小板反应蛋白和trem1[168,169]。hmgb-1/dna复合物结合rage并诱导从细胞凋亡到自噬的转换[169]。hmgb-1/cxcl12结合cxcr4介导炎症细胞的募集[170]。
[0181]
优选地,本发明的载体是dna质粒或doggybone(dbdna)载体。这类载体及其生产方法在本领域中是公知的。具体地,dbdna载体及其生产方法描述于wo2010/086626中。
[0182]
本发明的载体可以是rna。有两类mrna疫苗,一类是使用非复制性mrna的疫苗,另一类使用自我复制性rna的疫苗。本发明预期二者。非复制性mrna疫苗仅包含感兴趣的抗原的转录物,而自我复制性rna疫苗除感兴趣的抗原之外还包含rna复制机制进行mrna扩增所需的转录物。自我复制性rna疫苗仅由小剂量诱导产生大量抗原;这具有的优势是疫苗的开发和制造与其他平台相比不那么复杂,且成本也低很多。然而,rna疫苗半衰期很短,因此不能维持产生短暂保护的抗原的生产。对于非复制性和自身复制性mrna疫苗二者,必须对mrna进行配制以防止降解或将mrna封闭在载体内,该载体保护mrna在宿主细胞摄取之前不被核酸酶降解。已成功地使用了许多不同的载体[171-174],这些主要基于包封mrna并促进细胞摄取的脂质-纳米颗粒。本发明考虑使用这些mrna疫苗。
[0183]
本发明提供了
[0184]
·
疫苗,其包含本发明的多肽、核酸和/或载体以及任选地与佐剂组合,
[0185]
·
用作药物的本发明的多肽、核酸、载体和/或疫苗,
[0186]
·
用于治疗癌症或传染性疾病的本发明的多肽、核酸、载体和/或疫苗,
[0187]
·
用于治疗癌症或传染性疾病的方法,其包括向需要这种治疗的对象施用本发明的多肽、核酸、载体和/或疫苗。
[0188]
如本文所用,术语“治疗”包括可使人类或非人类动物受益的任何方案。治疗可以是遗传疾病或后天疾病的治疗。优选地,治疗是与细胞增殖相关的病症/障碍如癌症或传染性疾病的治疗。可用核酸治疗的癌症类型示例包括任何实体瘤,结肠直肠癌、肺癌、乳腺癌、胃癌、卵巢癌、子宫癌、肝癌、肾癌、胰腺癌、黑色素瘤、膀胱癌、头颈癌、脑癌、食道癌、胰腺癌和骨肿瘤,以及软组织癌和白血病。可用本发明治疗的传染性疾病示例包括细菌或病毒感染(如,冠状病毒、hiv、丙型肝炎病毒),或需要t细胞免疫以清除和中和mab以防止再感染的任何感染。
[0189]
在一些方面,本发明提供了用于在对象中预防或治疗癌症的本文所述的核酸、肽、
载体和/或疫苗,任选地,其中所述癌症是黑色素瘤。
[0190]
在另一些方面,本发明提供了用于在对象中预防或治疗传染性疾病的本文所述的核酸、肽、载体和/或疫苗,任选地,其中所述传染性疾病是covid-19。
[0191]
可向对象施用两种或更多种不同的肽和/或疫苗。优选地,向对象施用以下两种核酸:
[0192]
(a)编码多肽的核酸与编码受体结合结构域的第二核酸的组合,所述多肽包含seq id no:6提供的氨基酸序列,所述受体结合结构域包含seq id no:8提供的氨基酸序列;和
[0193]
(b)编码多肽的核酸与编码受体结合结构域的第二核酸的组合,所述多肽包含seq id no:7提供的氨基酸序列,所述受体结合结构域包含seq id no:9提供的氨基酸序列。
[0194]
核酸、多肽和/或载体可与药学上可接受的载体或多种载体组合使用。这类载体可包括但不限于盐水、缓冲盐水、葡萄糖、脂质体、水、甘油、乙醇和它们的组合。
[0195]
可用于本发明的核酸、多肽和/或载体可配制成药物组合物。除了一种或多种上述物质外,这些组合物还可包含药学上可接受的赋形剂、载体、缓冲剂、稳定剂或本领域技术人员熟知的其他物质。这样的物质应是无毒的且不应干扰活性成分的效力。载体或其他物质的精确性质可取决于施用途径,例如皮内、口服、静脉内、表皮或皮下、鼻内、肌内、腹膜内途径。制剂优选为以稳定干粉形式沉淀于微小金颗粒的表面且适合于通过基因枪注射,或为与get肽混合的dna溶液。制剂可适合于使用电穿孔皮内或肌内施用。制剂可适合于使用无针注射施用。
[0196]
包含核酸的组合物或用于递送核酸的组合物优选以“治疗有效量”施用于个体,这足以显示对个体的益处。实际施用量以及施用的速率和时间进程取决于所治疗疾病的性质和严重程度。治疗处方,例如用量等的决定,在一般执业医师和其他医生的责任范围内,通常考虑待治疗的病症、个体患者的状况、递送部位、施用方法和其他从业者已知的因素。本发明的核酸尤其涉及治疗现有癌症和在初始治疗或手术之后预防癌症复发。上述技术和方案的示例可见于remington’s pharmaceutical sciences,第16版,oslo,a.(编),1980。
[0197]
优选地,本发明的核酸刺激辅助和/或细胞毒性t细胞,当以有效量施用于人时,所述t细胞可显著杀死病毒感染的细胞或产生vnab以防止病毒进入。最佳剂量可由内科医生基于许多参数来确定,包括例如年龄、性别、体重、所治疗病症的严重程度、施用的活性成分和施用途径。例如,1-1000μg dna的剂量足以刺激辅助和细胞毒性t细胞应答。
[0198]
组合物可根据待治疗的病症单独或与其他治疗同时或顺序地组合施用。其他癌症治疗包括其他单克隆抗体、其他化疗剂、其他放射治疗技术、或本领域已知的其他免疫疗法。
[0199]
核酸的剂量取决于所使用药剂的性质,例如其结合活性和体内血浆半衰期、制剂中多肽的浓度、施用途径、给药的部位和速率、所涉及患者的临床耐受性、困扰患者的病理状况等,这也在医生的技能范围内。例如,每位患者每次施用200μg核酸的剂量是优选的,但是用量可在每剂约10μg至8mg的范围内。在一系列连续接种期间使用不同的用量;从业者可施用初始接种,然后用相对较小剂量的核酸加强。
[0200]
本发明的另一方面提供了包含如本文所公开的核酸的宿主细胞。本发明的核酸可整合到宿主细胞的基因组(如,染色体)中。整合可根据标准技术通过包含促进与基因组重组的序列来促进。核酸可在细胞内的染色体外载体上,或相反是对细胞可辨别地异源或外
0088046;ep-a-0143949;ep-a-0142541;jp-a-83-11808;美国专利号4,485,045和4,544,545。通常,脂质体是脂质含量大于约30mol.%胆固醇的小(约200-800埃)单层类型的脂质体,所选择的比例调整为最佳多肽泄漏速率。组合物可以局部方式施用于肿瘤部位或其他所需部位,或者可以以靶向肿瘤或其他细胞的方式递送。
[0210]
本发明的多肽可以全部或部分通过化学合成产生。该多肽可根据已建立的标准液体或优选固相肽合成方法容易地制备,其一般描述可广泛获得(参见,例如j.m.stewart and j.d.young(1984)[177],m.bodanzsky and a.bodanzsky(1984)[178];或者它们可通过液相方法或通过固相、液相和溶液化学的任何组合在溶液中制备,例如,通过先完成相应的肽部分,然后,如果需要和适当的话,在除去存在的任何保护基团之后,通过相应的碳酸或磺酸或其反应性衍生物的反应引入残基x。
[0211]
产生根据本发明的多肽的另一种方便的方法是通过在表达系统中使用核酸来表达编码它的核酸。本发明还提供了编码本发明多肽的分离的核酸。核酸包括dna和rna。本领域技术人员将能够确定这些核酸的替换、缺失和/或添加,这样的核酸仍将提供本发明的多肽。
[0212]
本发明还提供了包含至少一种如上所述的核酸的质粒、载体、转录或表达盒形式的构建体。本发明还提供了包含一种或多种上述构建体的重组宿主细胞。如上所述,编码本发明多肽的核酸形成本发明的一个方面,多肽的生产方法也是如此,该方法包括由其编码核酸表达。表达可方便地通过在合适的条件下培养包含核酸的重组宿主细胞来实现。在通过表达产生后,可使用任何合适的技术分离和/或纯化多肽,然后适当地使用。用于在多种不同的宿主细胞中克隆和表达多肽的系统是所熟知的。合适的宿主细胞包括细菌、哺乳动物细胞、酵母和杆状病毒系统。本领域可获得的用于表达异源多肽的哺乳动物细胞系包括中国仓鼠卵巢细胞/hela细胞、幼仓鼠肾细胞、nso小鼠黑色素瘤细胞等。一种常见的优选细菌宿主是大肠杆菌。多肽在原核细胞如大肠杆菌中表达在技术上很成熟。有关综述,请参见例如[179]。在培养物中在真核细胞中表达作为生产本发明多肽的选择对于本领域技术人员也是可用的,参见最近的综述例如[180,181]。
[0213]
可选择或构建合适的载体,所述载体包含合适的调控序列,所述调控序列包括启动子序列、终止子序列、聚腺苷酸化序列、增强子序列、标记基因和其他合适的序列。视情况而定,载体可以是质粒、病毒如噬菌体或噬菌粒。关于进一步的细节,参见例如[157]。在ausubel等(1992)[182]的文献中详细描述了许多用于操作核酸的已知技术和方案,例如制备核酸构建体、诱变、测序、将dna导入细胞和基因表达,以及分析蛋白。
[0214]
因此,本发明的又一方面提供了根据本发明的包含核酸的宿主细胞。还一方面提供了将这种核酸导入宿主细胞的方法。导入可采用任何可获得的技术。对于真核细胞,合适的技术可包括磷酸钙转染、deae葡聚糖、电穿孔、脂质体介导的转染以及使用逆转录病毒或其他病毒(如,痘苗病毒)转导,或对于昆虫细胞使用杆状病毒转导。对于细菌细胞,合适的技术可包括氯化钙转化、电穿孔和使用噬菌体转染。在导入后,可例如通过在表达基因的条件下培养宿主细胞,引起或允许核酸的表达。在一个实施方案中,本发明的核酸整合到宿主细胞的基因组(如,染色体)中。根据标准技术,可通过包含促进与基因组重组的序列来促进整合。本发明还提供了包括在表达系统中使用上述构建体以表达上述多肽的方法。
[0215]
片段可结晶区(fc区)是与被称为fc受体的细胞表面受体和补体系统的一些蛋白
相互作用的抗体尾区。这种特性允许抗体活化免疫系统。在igg抗体同种型中,fc区由来自抗体两条重链的第二和第三恒定结构域的两个相同的蛋白片段组成。igg的fc区包含高度保守的n糖基化位点。
[0216]
igg的fc区由一对成对的抗体hc结构域组成,每个结构域具有与ch3融合的ch2,其形成约50kda的结构。命名“片段,可结晶的”(fc)来自以下事实:在利用木瓜蛋白酶切割源自血清的骨髓瘤igg级分之后,可以结晶的唯一片段是成对的ch2-ch3片段。
[0217]
在fc内,两个ch3结构域彼此紧密结合,而两个ch2结构域彼此没有直接的蛋白-蛋白接触。寡糖与两个ch2结构域的每一个中的天冬酰胺297(n297)结合,填充两个ch2之间的部分空间。在一些晶体结构中,已观测到两个碳水化合物链之间直接和通过桥接水分子的氢键结合。尽管抗体似乎是高度分段的分子,但已证明fc的结构可影响抗原结合片段(fab)与靶向抗原的结合,并且类似地,fab中可变链的含量会影响fc与各种受体的结合。最近的圆二色性研究已证实了igg的fab臂和fc之间存在大量结构偶联。因此,igg分子是高度复杂的分子,其中不同的结构域明显相互作用,甚至在长距离上也是如此。
[0218]
亲合力是指单个非共价结合相互作用(如,蛋白受体与其配体之间的相互作用)的多重亲和力的累积强度,并且也可被称为“功能性亲和力”。因此,亲合力与固有亲和力不同,固有亲和力描述了单个相互作用的强度。然而,因为单独的结合事件增加了发生其他相互作用的可能性(即,增加了每个结合配偶体在结合位点附近的局部浓度),所以亲合力不应被认为仅是组成亲和力的总和,而是参与生物分子相互作用的所有亲和力的组合效果。“固有亲和力”和“功能性亲和力”之间的区别使用来自于每个术语中涉及的不同强调。当检查抗体结合位点和配体的互补区域之间的结构关系时,或者当研究特异性相互作用的动力学机制时,前者是最有用的。另一方面,当检测亲和力增强的定量测量时,后者特别重要,如在本发明中那样。
[0219]“功能性亲和力”和“固有亲和力”涉及以下形式上相同的可逆过程:
[0220]
复合物(单价)
[0221]
复合物(多价)
[0222]
其中f1为单价抗体片段,l1为单价配体,abn为多价抗体,以及lm为具有m个基团的多价配体。在各情况下,两个动力单元可逆地组合形成一个单元,并且每个过程原则上可由缔合常数表征。由于缔合常数是热力学亲和力的度量,因此两个过程都可指定亲和力的定量值。
[0223]
本发明还扩展至本文公开的任何肽序列的变体。如本文所用,术语“变体”涉及具有相似氨基酸序列和/或保留相同功能的蛋白。例如,术语“变体”包含蛋白或多肽,其包括一个或多个氨基酸添加、缺失、替换等。本发明的变体示例是包含如下定义的肽的蛋白,除了将一个或多个氨基酸替换为一个或多个其他氨基酸。例如,可进行氨基酸替换以减少或消除氨基酸序列中的负担。
[0224]
技术人员意识到各种氨基酸具有相似特性。物质的一个或多个这类氨基酸通常可被一个或多个其他这类氨基酸替换,而不会消除该物质的期望活性。
[0225]
因此,氨基酸甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸通常可相互替换(具有脂肪族侧链的氨基酸)。在这些可能的替换中,最好使用甘氨酸和丙氨酸来相互替换(因为它们具有相对较短的侧链),并且使用缬氨酸、亮氨酸和异亮氨酸来相互替换(因为它们具有
较大的疏水性脂肪族侧链)。其他经常可相互替换的氨基酸包括:苯丙氨酸、酪氨酸和色氨酸(具有芳香侧链的氨基酸);赖氨酸、精氨酸和组氨酸(具有碱性侧链的氨基酸);天冬氨酸和谷氨酸(具有酸性侧链的氨基酸);天冬酰胺和谷氨酰胺(具有酰胺侧链的氨基酸);以及半胱氨酸和蛋氨酸(具有含硫侧链的氨基酸)。这种性质的替换通常被称为“保守”或“半保守”氨基酸替换。
[0226]
使用三字母和一字母代码的天然存在的氨基酸可参照以下:甘氨酸(g或gly)、丙氨酸(a或ala)、缬氨酸(v或val)、亮氨酸(l或leu)、异亮氨酸(i或ile)、脯氨酸(p或pro)、苯丙氨酸(f或phe)、酪氨酸(y或tyr)、色氨酸(w或trp)、赖氨酸(k或lys)、精氨酸(r或arg)、组氨酸(h或his)、天冬氨酸(d或asp)、谷氨酸(e或glu)、天冬酰胺(n或asn)、谷氨酰胺(q或gln)、半胱氨酸(c或cys)、蛋氨酸(m或met)、丝氨酸(s或ser)和苏氨酸(t或thr)。残基可能是天冬氨酸或天冬酰胺时,可使用符号asx或b。残基可能是谷氨酸或谷氨酰胺时,可使用符号glx或z。除非上下文另有说明,否则提及天冬氨酸包括天冬氨酸盐,提及谷氨酸包括谷氨酸盐。
[0227]
氨基酸缺失或插入也可相对于下述融合蛋白的氨基酸序列进行。因此,例如,不会对多肽的活性产生实质性影响的氨基酸,或者至少不会消除这种活性的氨基酸,可以缺失。这种缺失是有利的,因为在仍然保留活性的同时,可减少多肽的总长度和分子量。这可使特定目的所需的多肽数量减少,例如,可减少用量水平。
[0228]
在一些实施方式中,以下氨基酸可相互交换进行保守氨基酸替换:
[0229]
类别可互换的氨基酸脂肪族甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸羟基或含硫/硒丝氨酸、半胱氨酸、苏氨酸、蛋氨酸芳香族苯丙氨酸、酪氨酸、色氨酸碱性组氨酸、赖氨酸、精氨酸酸性及其酰胺天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺
[0230]
因此,提及“保守”氨基酸替换是指氨基酸替换中抗体序列(如,cdr或vh或vl序列)中的一个或多个氨基酸被上述同一类中的另一个氨基酸替换。在cdr区中优选保守氨基酸替换以最小化对抗体功能的不利影响。然而,保守氨基酸替换也可发生在框架区。
[0231]
相对于下面给出的序列的氨基酸改变可使用任何合适的技术进行,例如通过使用定点诱变或固相合成。
[0232]
应当理解的是,在本发明范围内的氨基酸替换或插入可使用天然存在或非天然存在的氨基酸进行,但是天然存在的氨基酸可能是优选的。无论是否使用天然或合成氨基酸,优选仅存在l-氨基酸。
[0233]
本发明还提供了
[0234]
·
核酸疫苗,其中抗原是肿瘤特异性抗原或肿瘤相关抗原。
[0235]
·
核酸疫苗,其中抗原是病毒抗原或细菌抗原。
[0236]
·
核酸疫苗,其中抗原是产生t细胞应答和vnab的两种病毒蛋白。
[0237]
·
核酸疫苗,其中抗原是产生cd8 t细胞、cd4 t细胞和vnab的两种病毒蛋白。
[0238]
·
核酸疫苗,其中抗原是产生t细胞应答和vnab的病毒核衣壳蛋白和刺突蛋白的关键受体结合结构域。
[0239]
·
核酸疫苗,其中抗原是产生cd8 t细胞、cd4 t细胞和vnab的病毒核衣壳蛋白和刺突蛋白的关键受体结合结构域。
[0240]
·
核酸疫苗,其中抗原是产生t细胞应答和vnab的冠状病毒核衣壳蛋白和刺突蛋白的关键受体结合结构域。
[0241]
·
核酸疫苗,其中抗原是产生cd8 t细胞、cd4 t细胞和vnab的冠状病毒核衣壳蛋白和刺突蛋白的关键受体结合结构域。
[0242]
·
核酸疫苗,其中抗原是产生t细胞应答和vnab的sars-cov-2冠状病毒核衣壳蛋白和刺突蛋白的关键受体结合结构域。
[0243]
·
核酸疫苗,其中抗原是产生cd8 t细胞、cd4 t细胞和vnab的sars-cov-2冠状病毒核衣壳蛋白和刺突蛋白的关键受体结合结构域。
[0244]
·
如上所述的核酸疫苗,其中递送低剂量以引发高亲合力cd8 t细胞。
[0245]
·
如上所述的核酸疫苗,其中所述受体结合结构域与次要纤维蛋白三聚化。
[0246]
·
如上所述的核酸疫苗,其中所述受体结合结构域与用柔性gs接头连接的次要纤维蛋白三聚化。
[0247]
·
如上所述的核酸疫苗,其中所述受体结合结构域用额外的二硫键稳定。
[0248]
·
核酸疫苗,其编码具有人重链前导序列的covid-19刺突受体结合结构域aa 319-541和具有人重链前导序列的连接至人igg1 fc的铰链和ch2和ch3结构域的核衣壳蛋白。
[0249]
·
核酸疫苗,其编码具有人重链前导序列的连接至次要纤维蛋白的covid-19刺突受体结合结构域aa 319-541和具有人重链前导序列的连接至人igg1 fc的铰链和ch2和ch3结构域的核衣壳蛋白。
[0250]
·
核酸疫苗,其编码具有人重链前导序列的连接至人igg1 fc的铰链和ch2和ch3结构域的covid-19刺突受体结合结构域aa 319-541和具有人重链前导序列的核衣壳蛋白。
[0251]
·
核酸疫苗,其编码具有人重链前导序列的covid-19刺突受体结合结构域aa 319-541和具有人重链前导序列的核衣壳蛋白。
[0252]
·
核酸疫苗,其编码具有人重链前导序列的具有gs接头和次要纤维蛋白的covid-19刺突受体结合结构域aa 330-525和具有人重链前导序列的连接至人igg1 fc的铰链和ch2和ch3结构域的核衣壳蛋白。
[0253]
·
核酸疫苗,其编码具有人重链前导序列的具有gs接头和其他半胱氨酸残基的covid-19刺突受体结合结构域aa 330-525和具有人重链前导序列的连接至人igg1 fc的铰链和ch2和ch3结构域的核衣壳蛋白。
[0254]
·
经修饰的igg1抗体或其抗原结合片段,其包含免疫球蛋白的fc区的一个或多个残基以及结合区,其中所述fc区的一个或多个残基被修饰为小鼠igg3抗体的相应残基,并且与包含野生型fc区残基的相应igg1抗体或其抗原结合片段相比,所述经修饰的igg1抗体或其抗原结合片段具有增强的功能性亲和力。
[0255]
·
核酸疫苗,其包含经修饰的igg1抗体或其抗原结合片段,所述经修饰的igg1抗体或其抗原结合片段包含免疫球蛋白的fc区的一个或多个残基以及结合区,其中所述fc区的一个或多个残基被修饰为小鼠igg3抗体的相应残基,并且与包含野生型fc区残基的相应igg1抗体或其抗原结合片段相比,所述经修饰的igg1抗体或其抗原结合片段具有增强的功
能性亲和力。
[0256]
·
经修饰的igg1抗体或其抗原结合片段,其包含免疫球蛋白的fc区的一个或多个残基以及结合区,其中所述fc区的一个或多个残基被修饰为小鼠igg3抗体的相应残基,并且其中所述fc区的一个或多个残基选自:q342、p343、e345、n361、q362、p374、d376,任选地,其中所述fc区的一个或多个经修饰的残基选自:q342r、p343a、e345t、n361k、q362k、p374s、d376a。
[0257]
·
核酸疫苗,其包含经修饰的igg1抗体或其抗原结合片段,所述经修饰的igg1抗体或其抗原结合片段包含免疫球蛋白的fc区的一个或多个残基以及结合区,其中所述fc区的一个或多个残基被修饰为小鼠igg3抗体的相应残基,并且其中所述fc区的一个或多个残基选自:q342、p343、e345、n361、q362、p374、d376,任选地,其中所述fc区的一个或多个经修饰的残基选自:q342r、p343a、e345t、n361k、q362k、p374s、d376a。
[0258]
·
经修饰的igg1抗体或其抗原结合片段,其包含免疫球蛋白的fc区的一个或多个残基以及结合区,其中所述fc区的一个或多个残基被修饰为小鼠igg3抗体的相应残基,并且其中所述fc区的一个或多个残基选自:n286、k288、k290、q342、p343、e345、l351、t359、n361、q362、g371、p374、s375、d376、a378,任选地,其中所述fc区的一个或多个经修饰的残基选自:n286t、k288w、k290q、q342r、p343a、e345t、l351i、t359s、n361k、q362k、g371n、p374s、s375e、d376a、a378s。
[0259]
·
核酸疫苗,其包含经修饰的igg1抗体或其抗原结合片段,所述经修饰的igg1抗体或其抗原结合片段包含免疫球蛋白的fc区的一个或多个残基和结合区,其中所述fc区的一个或多个残基被修饰为小鼠igg3抗体的相应残基,并且其中所述fc区的一个或多个残基选自:n286、k288、k290、q342、p343、e345、l351、t359、n361、q362、g371、p374、s375、d376、a378,任选地,其中所述fc区的一个或多个经修饰的残基选自:n286t、k288w、k290q、q342r、p343a、e345t、l351i、t359s、n361k、q362k、g371n、p374s、s375e、d376a、a378s。
[0260]
·
经修饰的igg1抗体或其抗原结合片段,其包含免疫球蛋白的fc区的一个或多个残基以及结合区,其中所述fc区的一个或多个残基被修饰为小鼠igg3抗体的相应残基,并且其中所述fc区的一个或多个残基选自:n286、k288、k290、a339、q342、p343、r344、e345、l351、s354、d356、e357、l358、t359、n361、q362、k370、g371、y373、p374、s375、d376、a378,任选地,其中所述fc区的一个或多个经修饰的残基选自:n286t、k288w、k290q、a339p、q342r、p343a、r344q、e345t、l351i、s354p、d356e、e357q、l358m、t359s、n361k、q362k、k370t、g371n、y373f、p374s、s375e、d376a、a378s。
[0261]
·
核酸疫苗,其包含经修饰的igg1抗体或其抗原结合片段,所述经修饰的igg1抗体或其抗原结合片段包含免疫球蛋白的fc区的一个或多个残基以及结合区,其中所述fc区的一个或多个残基被修饰为小鼠igg3抗体的相应残基,并且其中所述fc区的一个或多个残基选自:n286、k288、k290、a339、q342、p343、r344、e345、l351、s354、d356、e357、l358、t359、n361、q362、k370、g371、y373、p374、s375、d376、a378,任选地,其中所述fc区的一个或多个经修饰的残基选自:n286t、k288w、k290q、a339p、q342r、p343a、r344q、e345t、l351i、s354p、d356e、e357q、l358m、t359s、n361k、q362k、k370t、g371n、y373f、p374s、s375e、d376a、a378s。
[0262]
·
经修饰的igg1抗体或其抗原结合片段,其包含免疫球蛋白的fc区的一个或多个
残基以及结合区,其中所述fc区的一个或多个残基被修饰为小鼠igg3抗体的相应残基,并且其中所述fc区的一个或多个残基选自:n286、k288、k290、e294、y300、v305、a339、q342、p343、r344、e345、l351、s354、d356、e357、l358、t359、n361、q362、k370、g371、y373、p374、s375、d376、a378,任选地,其中所述fc区的一个或多个经修饰的残基选自:n286t、k288w、k290q、e294a、y300f、v305a、a339p、q342r、p343a、r344q、e345t、l351i、s354p、d356e、e357q、l358m、t359s、n361k、q362k、k370t、g371n、y373f、p374s、s375e、d376a、a378s。
[0263]
·
核酸疫苗,其包含经修饰的igg1抗体或其抗原结合片段,所述经修饰的igg1抗体或其抗原结合片段包含免疫球蛋白的fc区的一个或多个残基以及结合区,其中所述fc区的一个或多个残基被修饰为小鼠igg3抗体的相应残基,并且其中所述fc区的一个或多个残基选自:n286、k288、k290、e294、y300、v305、a339、q342、p343、r344、e345、l351、s354、d356、e357、l358、t359、n361、q362、k370、g371、y373、p374、s375、d376、a378,任选地,其中所述fc区的一个或多个经修饰的残基选自:n286t、k288w、k290q、e294a、y300f、v305a、a339p、q342r、p343a、r344q、e345t、l351i、s354p、d356e、e357q、l358m、t359s、n361k、q362k、k370t、g371n、y373f、p374s、s375e、d376a、a378s。
[0264]
本发明各个方面的优选特征在进行必要的必要修改后用于各其他方面。本文提及的现有技术文件以法律允许的最大程度并入。
[0265]
在描述本发明的实施方式时,术语不打算局限于如此选择的特定术语,并且应理解,每个特定术语包括以类似方式操作而实现类似目的的所有技术等价物。
实施例
[0266]
现在将参考以下实施例和和附图进一步描述本发明。未来的数据收集来自使用电穿孔利用新的pdna疫苗进行免疫的健康志愿者,该新的pdna疫苗被工程化以诱导vnab和强效t细胞免疫,已了解这些数据作为实施例效果的直接结果。
[0267]
图1:pvaxdcib68的图谱和克隆策略
[0268]
描绘克隆位点bamhi*/xhoi*和hindiii**/psti**,分别用于在第一轮克隆*和第二轮克隆**中切除轻链和重链并用s和n区段取代。
[0269]
图2:pvaxdcsn1的序列;sn1
[0270]
表达载体pvaxdc内的s糖蛋白和n全长链的核苷酸和氨基酸序列。s链编码rbd氨基酸319-541和鼠igk前导序列。核蛋白链编码与人igg1铰链-ch2-ch3在框内融合的氨基酸2-419以及鼠igk前导序列。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0271]
图3:pvaxdcsn2的序列;sn2
[0272]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含鼠igk前导序列。s链编码通过甘氨酸丝氨酸与次要纤维蛋白三聚体基序连接的rbd氨基酸319-541。n链编码与人igg1铰链-ch2-ch3在框内融合的氨基酸2-419。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0273]
图4:pvaxdcsn3的序列;sn3
[0274]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含鼠igk前导序列。s链编码与人igg1铰链-ch2-ch3在框内融合的rbd氨基酸319-541。n链编码氨基酸
2-419。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0275]
图5:pvaxdcsn4的序列;sn4
[0276]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含鼠igk前导序列。s糖蛋白链编码rbd氨基酸319-541,n链编码氨基酸2-419。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0277]
图6:pvaxdcsn5的序列;sn5
[0278]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。s链编码rbd氨基酸319-541和人igh前导序列。n链编码与人igg1铰链-ch2-ch3在框内融合的氨基酸2-419以及人igh前导序列。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0279]
图7:pvaxdcsn6的序列;sn6
[0280]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。s链编码通过甘氨酸丝氨酸与次要纤维蛋白三聚体基序连接的rbd氨基酸319-541。n链编码与人igg1铰链-ch2-ch3在框内融合的氨基酸2-419。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0281]
图8:pvaxdcsn7的序列;sn7
[0282]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。s链编码与人igg1铰链-ch2-ch3在框内融合的rbd氨基酸319-541。n链编码氨基酸2-419。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0283]
图9:pvaxdcsn8的序列;sn8
[0284]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。s糖蛋白链编码rbd氨基酸319-541,n链编码氨基酸2-419。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0285]
图10:pvaxdcsn9的序列;sn9
[0286]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。s链编码通过较长(gggs)3gs甘氨酸丝氨酸接头与次要纤维蛋白三聚体基序(gtgggsg)连接的rbd氨基酸330-525。n链编码与人igg1铰链-ch2-ch3在框内融合的氨基酸2-419。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0287]
图11:pvaxdcsn10的序列;sn10
[0288]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。s链编码通过(gggs)3甘氨酸丝氨酸接头与二硫桥基序连接的rbd氨基酸330-525。n链编码与人igg1铰链-ch2-ch3在框内融合的氨基酸2-419。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0289]
图12:pvaxdcsn11的序列;sn11
[0290]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。s链编码通过较长(gggs)3gs甘氨酸丝氨酸接头与次要纤维蛋白三聚体基序
(gtgggsg)连接的rbd氨基酸330-525。n链编码与人igg1铰链-ch2-ch3 iv1在框内融合的氨基酸2-419,其中鼠igg3 23aa替换以粗体突出显示。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0291]
图13:pvaxdcsn12的序列;sn12
[0292]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。s链编码通过甘氨酸丝氨酸与次要纤维蛋白三聚体基序连接的rbd氨基酸319-541。n链编码与人igg1铰链-ch2-ch3 iv1在框内融合的氨基酸2-419,其中鼠igg3 23aa替换以粗体突出显示。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0293]
图14:pvaxdcsn13的序列;sn13
[0294]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。s链编码与人igg1铰链-ch2-ch3在框内融合的rbd氨基酸319-541。n链编码与人igg1铰链-ch2-ch3 iv1在框内融合的氨基酸2-419,其中鼠igg3 23aa替换以粗体突出显示。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0295]
图15:pvaxdcsn14的序列;sn14
[0296]
表达载体pvaxdc内的s和n全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。s链编码rbd氨基酸319-541,n链编码氨基酸2-419,它们都与人igg1铰链-ch2-ch3 iv1恒定区融合,其中鼠igg3 23aa替换以粗体突出显示。为了降低sn14中两个密码子优化的人igg1铰链-ch2-ch3 iv1恒定区之间的同源性,核苷酸序列不相同。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0297]
图16:利用各自的sn构建体瞬时转染hek293之后6天条件培养基中的rbd和n分泌水平(通过夹心elisa)。
[0298]
图17:hhdii小鼠在第1、8和15天通过基因枪利用sn8、sn9、sn10和sn11(a)或sn8、sn10和sn11(b)pdna进行免疫。在第21天通过elispot测定分析脾细胞针对培养基对照,s1、rbd和n蛋白,n和rbd肽库,以及单个n和rbd肽的ifnγ应答。应答显示为平均斑点/百万个脾细胞。空心圆对肽的应答,实心圆对蛋白的应答,红色对n抗原的应答,蓝色对s抗原、rbd、s1的应答。
[0299]
图18:hhdii/dr1小鼠在第1、8天和15天通过基因枪利用sn8(a)、sn9(b)、sn10(c)和sn11(d)pdna进行免疫。在第21天通过elispot测定分析脾细胞针对培养基对照,s1、rbd和n蛋白,n和rbd肽库,以及单个n和rbd肽的ifnγ应答。应答显示为平均斑点/百万个脾细胞。空心圆对肽的应答,实心圆对蛋白的应答,红色对n抗原的应答,蓝色对s抗原、rbd、s1的应答。
[0300]
图19:在elispot中,通过基因枪利用sn8、sn9或sn11 pdna免疫的小鼠对n蛋白(a),n 138-147肽(b),s1蛋白(c)和rbd蛋白(d)的ifnγ应答比较。从两个独立研究中收集数据。应答相对于背景对照归一化。应答显示为平均斑点/百万个脾细胞。
[0301]
图20:hhdii/dp4小鼠在第1、15和29天通过基因枪利用sn2(a)、sn3(b)和rsn4(c)pdna进行免疫。在第35天通过elispot测定分析脾细胞针对介质对照,s1、rbd和n蛋白,rbd肽库,以及单个n和rbd肽的ifnγ应答。应答显示为平均斑点/百万个脾细胞。空心圆对肽的
应答,实心圆对蛋白的应答,红色对n抗原的应答,蓝色对s抗原、rbd、s1的应答。
[0302]
图21:hhdii/dp4小鼠在第1、15和29天通过基因枪利用sn2、sn3和sn4 pdna进行免疫。在第35天通过elispot测定分析脾细胞对s1蛋白滴定量的ifnγ应答。亲合力计算为引起50%最大应答的蛋白浓度。滴定曲线显示为斑点/百万个脾细胞,并且应答归一化显示为%最大应答曲线。
[0303]
图22:hhdii小鼠在第1、8和15天通过基因枪利用sn11 pdna进行免疫。在第21天通过elispot测定分析脾细胞对rbd 417-425肽滴定量的ifnγ应答。亲合力计算为引起50%最大应答的蛋白浓度。滴定曲线显示为斑点/百万个脾细胞。
[0304]
图23:hhdii小鼠在第1、8和15天通过基因枪利用sn10或sn11 pdna进行免疫。在第21天通过elispot测定分析脾细胞对n 138-146肽滴定量的ifnγ应答。亲合力计算为引起50%最大应答的蛋白浓度。滴定曲线显示为斑点/百万个脾细胞。
[0305]
图24:hhdii/dp4小鼠在第1、15和29天通过基因枪利用sn5、sn6、sn9、sn10和sn11(a)sn2、sn3和sn4(b)pdna进行免疫或在第1、8、15天通过基因枪利用sn3、sn8、sn10和sn11(c)pdna进行免疫。在第35天(a和b)或第21天(c),通过elisa对1/100、1/1000和1/10000稀释度下的血清分析对s1、n和rbd蛋白的抗体应答。
[0306]
图25:在第1、15和29天通过基因枪利用sn5、sn6、sn9、sn10和sn11免疫的hhdii/dp4小鼠第35天采集血清进行替代中和测定(rbd结合抑制测定)。来自幼稚小鼠的血清用作阴性对照,鼠s1抗体(sinobiological)作为另外的阳性对照。
[0307]
图26:假病毒中和测定。hhdii/dp4小鼠在第1、15和29天通过基因枪利用sn5、sn6、sn9、sn10、sn11、sn2、sn3和sn4 pdna进行免疫。第35天采集血清在1/100稀释度下测试sars-cov-2(a)或与无关病毒(vsv g)(b)的中和。在不同的血清稀释度下同样分析了病毒中和(c)。50%中和滴度(id50)(d)。
[0308]
图27:vaxdcsn15的序列;sn15
[0309]
表达载体pvaxdc中刺突蛋白和核蛋白全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。刺突链编码氨基酸319-541。核蛋白链编码与人igg1铰链-ch2-ch3 iv1在框内融合的氨基酸2-419,其中鼠igg3 23aa替换以粗体突出显示。终止密码子用星号表示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0310]
图28:pvaxdcib68(scib1)的序列
[0311]
在表达载体pvaxdc内分别与人igg1 ch1-铰链-ch2-ch3恒定区和人κ恒定区在框内克隆的抗体重链和轻链可变区的核苷酸和氨基酸序列。方框内的氨基酸编码h1和l3中的hla-dr7、hla-dr53和hla-dq6限制的gp100
173-190
cd4表位(gtgramlgthtmevtvyh),h2中的hla-0201trp2
180-188
表位(svydffvwl),以及h3和l1中的hla-dr4限制的gp100
44-59 cd4表位(wnrqlypewteaqrld)。突出显示了用于可变重链和轻链区转移的hindiii/afe i和bamhi/bsiwi限制性位点。为了直接用增强的人igg1 ch1-铰链-ch2-ch3 iv1恒定区取代人igg1恒定区结构域(ch1-铰链-ch2-ch3),如所示使用afei和ecori。终止密码子用星号表示。
[0312]
图29:pvaxdcib68 iv1(iscib1)的序列
[0313]
在表达载体pvaxdc内分别与增强的人igg1 ch1-铰链-ch2-ch3 iv1恒定区(其中鼠igg3 23aa替换以粗体突出显示)和人κ恒定区在框内克隆的抗体重链和轻链可变区的核苷酸和氨基酸序列。方框内的氨基酸编码h1和l3中的hla-dr7、hla-dr53和hla-dq6限制的
gp100
173-190
cd4表位(gtgramlgthtmevtvyh),h2中的hla-0201trp2
180-188
表位(svydffvwl),h3和l1中的hla-dr4限制的gp100
44-59 cd4表位(wnrqlypewteaqrld)。突出显示了用于可变重链和轻链区转移的hindiii/afe i和bamhi/bsiwi限制性位点。用增强的人igg1 ch1-铰链-ch2-ch3 iv1恒定区直接取代人igg1恒定区结构域(ch1-铰链-ch2-ch3),如所示使用afei和ecori。终止密码子用星号表示。
[0314]
图30:pvaxdcib238(scib1 plus)的序列
[0315]
在表达载体pvaxdc内分别与人igg1 ch1-铰链-ch2-ch3恒定区和人κ恒定区在框内克隆的抗体重链和轻链可变区的核苷酸和氨基酸序列。方框内的氨基酸代表从pvaxdcib68保留的cdr h1中的hla-dr7、hla-dr53和hla-dq6限制的gp100
173-190
cd4表位(gtgramlgthtmevtvyh),h2中的hla-0201trp2
180-188
表位(svydffvwl),l1中的hla-dr4限制的gp100
44-59 cd4表位(wnrqlypewteaqrld)。其他表位包括嵌套在插入h3位点中的gp100
471-492
序列(vpldcvlyrygsfsvtldivqg)内,其是hla-a1,b35和预测的hla-dp4表位。将trp2
177-205
和trp2
60-91
序列分别移植到可变轻链区的l2和l3位点。它们共同包含hla-a2、a3、a31、a33、b35、b44、hla-dr3以及如别处所述的另一种潜在的hla-dp4表位。突出显示了用于可变重链和轻链区转移的hindiii/afe i和bamhi/bsiwi限制性位点。为了直接用增强的人igg1 ch1-铰链-ch2-ch3 iv1恒定区取代人igg1恒定区结构域(ch1-铰链-ch2-ch3),如所示使用afei和ecori。终止密码子用星号表示。
[0316]
图31:pvaxdcib238 iv1(iscib1 plus)的序列
[0317]
在表达载体pvaxdc内分别与增强的人igg1 ch1-铰链-ch2-ch3 iv1恒定区(其中鼠igg3 23aa替换以粗体突出显示)和人κ恒定区在框内克隆的抗体重链和轻链可变区的核苷酸和氨基酸序列。方框内的氨基酸代表从pvaxdcib68保留的cdr h1中的hla-dr7、hla-dr53和hla-dq6限制的gp100
173-190
cd4表位(gtgramlgthtmevtvyh),h2中的hla-0201trp2
180-188
表位(svydffvwl),以及l1中的hla-dr4限制的gp100
44-59 cd4表位(wnrqlypewteaqrld)。其他表位包括嵌套在插入h3位点中的gp100
471-492
序列(vpldcvlyrygsfsvtldivqg)内,其是hla-a1,b35和预测的hla-dp4表位。将trp2
177-205
和trp2
60-91
序列分别移植到可变轻链区的l2和l3位点。它们共同包含hla-a2、a3、a31、a33、b35、b44、hla-dr3和另一种潜在的hla-dp4表位。突出显示了用于可变重链和轻链区转移的hindiii/afe i和bamhi/bsiwi限制性位点。用增强的人igg1 ch1-铰链-ch2-ch3 iv1恒定区直接取代人igg1恒定区结构域(ch1-铰链-ch2-ch3),如所示使用afe i和ecori。终止密码子用星号表示。
[0318]
图32:pvaxdcib178(scib2)的序列
[0319]
在表达载体pvaxdc内分别与人igg1 ch1-铰链-ch2-ch3恒定区和人κ恒定区在框内克隆的抗体重链和轻链可变区的核苷酸和氨基酸序列。方框内的氨基酸代表cdr h1和h2中nyeso-1
158-166
hla-a24表位(llmwitqcf)和hla-a2-限制的nnyeso-1
157-165
表位(sllmwitqc)。移植到cdr h3和l1位点中的ny-eso-1
83-111
氨基酸序列(pesrllefylampfatpmeaelarrslaq)和ny-eso-1
119-143
(pgvllkeftvsgniltirltaadhr)共同包含如别处所述(xue et al.oncoimmunology 2016,vol.5,no.6,e1169353)的大量嵌套的其他表位。突出显示了用于可变重链和轻链区转移的hindiii/afe i和bamhi/bsiwi限制性位点。为了用增强的人igg1 ch1-铰链-ch2-ch3iv1恒定区afei和ecori直接取代人igg1恒
定区结构域(ch1-铰链-ch2-ch3),如所示使用afei和ecori。终止密码子用星号表示。
[0320]
图33:pvaxdcib178 iv1(iscib2)的序列
[0321]
在表达载体pvaxdc内分别与增强的人igg1 ch1-铰链-ch2-ch3 iv1恒定区(其中鼠igg3 23aa替换以粗体突出显示)和人κ恒定区在框内克隆的抗体重链和轻链可变区的核苷酸和氨基酸序列。方框内的氨基酸代表cdr h1和h2中nyeso-1
158
–
166
hla-a24表位(llmwitqcf)和hla-a2-限制的nyeso-1
157
–
165
表位(sllmwitqc)。移植到cdr h3和l1位点中的ny-eso-1
83-111
氨基酸序列(pesrllefylampfatpmeaelarrslaq)和ny-eso-1
119-143
(pgvllkeftvsgniltirltaadhr)共同包含如别处所述的大量嵌套的其他表位[183]。突出显示了用于可变重链和轻链区转移的hindiii/afe i和bamhi/bsiwi限制性位点。为了用增强的人igg1 ch1-铰链-ch2-ch3 iv1恒定区直接取代人igg1恒定区结构域(ch1-铰链-ch2-ch3),如所示使用afei和ecori。终止密码子用星号表示。
[0322]
图34:c57bl/6或hla-dr4小鼠在第1、8和15天通过基因枪利用scib1或iscib1pdna进行免疫。第21天通过elispot测定分析脾细胞对trp2 180-188肽(a-c)或gp100 44-59肽(d)的ifnγ应答。比较了不同小鼠品系中的trp2 180-188应答频率(a)。b和c,trp2180-188应答亲合力计算为引起50%最大应答的肽浓度。滴定曲线显示为最大应答%。d,hla-dr4小鼠中对0.1μg/ml gp100 44-59肽的应答频率。
[0323]
图35:c57bl/6、hhdii、hhdii/dp4或hla-dr4小鼠在第1、8和15天通过基因枪利用scib1plus或iscib1plus pdna进行免疫。第21天通过elispot测定分析脾细胞对trp2180-188肽(a-c)或gp100 44-59肽(d)的ifnγ应答。比较了不同小鼠品系中的应答频率(a)。b和c,trp2 180-188应答亲合力计算为引起50%最大应答的肽浓度。滴定曲线显示为最大应答%。d,hla-dr4小鼠对1μg/ml gp100 44-59肽的应答频率。
[0324]
图36:c57bl6小鼠在第1天植入b16f1肿瘤细胞,随后在第4、11和18天利用pdna scib1、iscib1、scib1plus或iscib1plus进行免疫。a,肿瘤生长曲线。b,第18天的肿瘤体积比较。c,总体存活率。
[0325]
图37:hhdii或hhdii/dr1小鼠在第1、8和15天通过基因枪利用scib2或iscib2pdna进行免疫。第21天通过elispot测定分析脾细胞对nyeso1 157-165肽(a-c)或nyeso1119-143肽(d和e)的ifnγ应答。比较不同小鼠品系中的nyeso1 157-165应答频率(a)。b和c,nyeso1 157-165应答亲合力计算为引起50%最大应答的肽浓度。滴定曲线显示为最大应答%。d,hhdii/dr1小鼠中对10μg/ml nyeso1 119-143肽的应答频率。e,hhdii/dr1小鼠中nyeso1 119-143应答亲合力计算为引起50%最大应答的肽浓度。滴定曲线显示为最大应答%。
[0326]
图38:hhdii小鼠在第1天植入b16 hhdii nyeso肿瘤细胞,随后在第4、8和11天利用pdna scib2或iscib2进行免疫并监测随时间的无肿瘤存活率。
[0327]
图39:hla-a2转基因或balb/c小鼠在第1、8和15天通过基因枪利用sn13或sn14pdna进行免疫。第21天通过elispot测定分析脾细胞对rbd肽库的ifnγ应答频率(a)或通过肽滴定对rbd 417-425肽的亲合力。亲合力计算为引起50%最大应答的肽浓度。滴定曲线显示为最大应答%。第21天的血清稀释液在elisa测定中分析s1蛋白特异性抗体应答(c)或在假病毒中和测定中分析sars-cov-2中和抗体(d)。
[0328]
图40:在用各自的sn构建体瞬时转染hek293之后6天,条件培养基和细胞裂解物中
的rbd(a)和n(b)分泌水平(通过夹心elisa)。
[0329]
图41:c57bl/6(c)或balb/c(a和b)小鼠在第1、8和15天通过基因枪利用sn11(小rbd三聚体)、sn12(rbd三聚体)、sn13(rbd-fc)、sn15(rbd单体)pdna进行免疫,所有这些构建体还包含经修饰的fc-n或完整s。第21天的血清稀释液在elisa测定中分析s1蛋白特异性抗体应答(a)或在假病毒中和测定中分析sars-cov-2中和抗体(b和c)。
[0330]
图42:hla-a2转基因c57b1/6或balb/c小鼠在第1、8和15天通过基因枪利用sn11(小rbd三聚体)、sn12(rbd三聚体)、sn13(rbd-fc)、sn15(rbd单体)进行免疫,所有这些构建体还包含经修饰的fc。第21天通过elispot测定分析脾细胞对rbd肽库(ai和b)和对rbd 417-425肽(aii)的ifnγ应答频率。
[0331]
图43:cm5芯片上捕获的渐增cd64水平下rbd-fc和rbd-ifcv1相互作用的实时结合曲线(spr,biat200)。
[0332]
图44:a.健康供体t细胞增殖应答(20个供体的组)。与itv1、和klh温育之后,第5、6、7和8天从大量培养物取样pbmc并评估增殖。使用非配对双样本学生t检验,具有si≥1.90的增殖应答是显著的(p《0.05,用红色虚线表示),被认为是阳性。b.显示健康供体t细胞对itv1、和应答的箱线图。图显示随着时间进程获得的cd4+t细胞的最大增殖。棒代表10-90百分位数。显示使用dunn's检验后配对比较的重复测量单因素anova(friedman检验)进行统计分析。**p《0.01
[0333]
图45:a.50个供体的组的健康供体t细胞增殖应答。与itv1、和klh温育之后,第5、6、7和8天从大量培养物取样pbmc并评估增殖。使用非配对双样本学生t检验,具有si≥1.90的增殖应答是显著的(p《0.05,用红色虚线表示),被认为是阳性。b.显示健康供体t细胞对itv1、和应答的箱形图。图显示随着时间进程获得的cd4+t细胞的最大增殖。棒代表10-90百分位数。显示使用dunn's检验后配对比较的重复测量单因素anova(friedman检验)进行统计分析。**p《0.01,****p《0.0001
[0334]
图46:第21天在elisa测定中分析第1、8和15天通过基因枪利用np、npfc或npfciv1免疫的小鼠血清对n蛋白的特异性抗体应答。
[0335]
图47:pvaxdcsn16的序列;sn16
[0336]
表达载体pvaxdc中刺突蛋白和核蛋白全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。刺突链编码携带kent变体/谱系b.1.1.7,uk-voc 202012/01的n501y突变的氨基酸319-541。核蛋白链编码包括来自变体的d3l和s235f突变的氨基酸2-419,与人igg1铰链-ch2-ch3 iv1在框内融合,其中鼠igg3 23aa替换为粗体。终止密码子用星号表示。kent变体/谱系b.1.1.7,uk-voc 202012/01的突变以粗体灰色突出显示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0337]
图48:pvaxdcsn17的序列;sn17
[0338]
表达载体pvaxdc中刺突蛋白和核蛋白全长链的核苷酸和氨基酸序列。两条链都包含人igh前导序列。刺突链编码携带南非变体voc 501y.v2/b1.351的k417n、e484k和n501y突变的氨基酸319-541。核蛋白链编码包括来自变体的t205i突变的氨基酸2-419,与人igg1铰链-ch2-ch3 iv1在框内融合,其中鼠igg3 23aa替换为粗体。终止密码子用星号表示。南
非变体voc 501y.v2/b1.351的突变以粗体灰色突出显示。突出显示了用于转移两条链的bamhi/xhoi和hindiii/psti限制性位点。
[0339]
图49:balb/c小鼠在第1、8和15天通过基因枪利用sn15(rbd单体且n连接至经修饰的fc(fciv1))进行免疫。在elisa中以血清稀释度倒数分析第21天的血清对谱系a(武汉)、b.1.351和b.1.1.7s1蛋白变体的抗体反应性。显示ec
50
值。
[0340]
图50:balb/c小鼠在第1、8和15天通过基因枪利用sn15(rbd单体且n连接至经修饰的fc(fciv1))、sn16(rbd单体且n连接至经修饰的fc(fciv1)-b.1.1.7变体)、sn17(rbd单体且n连接至经修饰的fc(fciv1)-b.1.351变体),或完整s dna进行免疫。第21天,在elisa中以血清稀释度倒数分析sn16和sn17免疫的小鼠(a)或sn15、sn17和完整s dna免疫的小鼠(b)血清对谱系a(武汉)、b.1.351和b.1.1.7s1蛋白变体的抗体反应性。显示ec
50
值。c.使用msd技术在1/100血清稀释度下评估来自sn15、sn17、完整s dna、幼稚小鼠和对照nibsc 20/136的血清的变体rbd(i)和s1(ii)蛋白的ace2结合抑制。bsa-pbs用作阴性对照。
[0341]
图51:balb/c小鼠在第1、8和15天利用sn15或sn17 dna构建体进行免疫,并在第21天采集血清,在假型中和测定中针对谱系a或b.1.351假型病毒(a)分析或在活病毒中和测定中针对谱系a病毒(b)分析。数据是不同血清滴定下的读数且代表多个实验。
[0342]
图52:balb/c小鼠第1、8和15天利用sn15或sn17 dna构建体进行免疫,并在第21天采集脾细胞,通过ifnγelispot测定分析对rbd或n肽库的t细胞应答。符号代表单个小鼠的平均应答,线代表小鼠之间的平均值。从多项独立研究中收集数据。
[0343]
图53:balb/c小鼠在第1天和第29天利用sn15(rbd单体且n连接至经修饰的fc(fciv1))或psn17(bd单体且n连接至经修饰的fc(fciv1)-b.1.351变体)进行免疫,随后在第85天利用sn17 dna加强免疫。第42、82或98天,在elisa中以血清稀释度倒数分析经免疫小鼠血清对谱系a(武汉)和b.1.351s1蛋白变体(a)或b.1.351和b.1.617.2rbd蛋白变体(b)的抗体反应性。显示ec
50
值。
[0344]
图54:sn15完整质粒载体核苷酸序列(seq id no:23)。
[0345]
图55:sn17完整质粒载体序列(seq id no:24)。
[0346]
图56:sn17完整doggbyone(dbdna)载体序列(seq id no:25)。
[0347]
图57:iscib1plus完整质粒载体序列(seq id no:20)。
[0348]
图58:iscib1plus完整doggybone(dbdna)载体序列(seq id no:21)。
[0349]
图59:iscib2完整质粒载体序列(seq id no:22)。
[0350]
方法
[0351]
材料、动物、细胞和抗体
[0352]
肽和蛋白
[0353]
基于iedb数据库(http://www.iedb.org/)对hla-a*0201、hla-dr*0101和hla-dp*0401的结合预测以及基于syfpeithi(http://www.syfpeithi.de)对hla-a*0201的结合预测,选择covid19肽。基于公开的序列、iedb数据库(http://www.iedb.org/)结合预测以及syfpeithi(http://www.syfpeithi.de)结合预测,选择癌症抗原肽。肽(表2)以纯度》90%合成(genscript),等分至一次性小瓶中,并于-80℃冻干储存,使用当天在pbs中重构。重组n、s1和his标记rbd蛋白购自genescript(usa)。n肽库购自miltenyi biotec(uk),以及rbd肽库购自jpt peptide technologies(德国)。
[0354]
表2covid19 t细胞表位
[0355][0356]
*mhci结合预测于04/03/2020使用iedb分析资源netmhcpan(4.0版)工具[184]进行。
[0357]
¥
公布为已知covid表位的肽
[0358]
表3癌症抗原t细胞表位
[0359][0360]
质粒
[0361]
所有covid-19质粒pvaxdcsn1-sn14(sn1-15)的主链都源自fda监管的用于人类的pvax1(invitrogen)的可塑性载体骨架。所有用于插入的核苷酸区段都是针对人类表达进行优化的密码子。sn1-sn4包含鼠igk前导序列,而sn5-15包含人igh前导序列。合成编码以下的密码子优化核苷酸区段:前导序列,单独的s糖蛋白rbd结构域319-541或330-525的氨基酸(登录号yp_009724390)、与huigg1恒定结构域的铰链-ch2-ch3结构域(登录号p01857)或变体铰链-ch2-ch3iv1(其中23个氨基酸已被鼠igg3残基取代)在框内融合的s糖蛋白rbd结构域319-541或330-525的氨基酸、或通过甘氨酸丝氨酸接头连接至次要纤维蛋白三聚体折叠基序或二硫桥基序的s糖蛋白rbd结构域319-541或330-525的氨基酸,并且合成的核苷酸区段在5’和3’端分别插入bamhi和xhoi位点。在第一轮克隆中,将这些区段插入图1所示的pvaxdcib68构建体的bamhi/xhoi位点,直接取代第一表达盒中的κ轻链形成中间质粒。
[0362]
在第二轮克隆中,合成编码以下的密码子优化核苷酸区段:前导序列,单独的全长核蛋白氨基酸2-419(登录号yp_009724397)、或与huigg1恒定结构域的铰链-ch2-ch3结构域或变体铰链-ch2-ch3iv1在框内融合的全长核蛋白氨基酸2-419,并且核苷酸区段两侧有hindiii/psti。使用hindiii/psti将来自第一轮形成的中间载体的重链切除,并在图1所示适当s区段旁边用第二表达盒中的n区段取代。
[0363]
为了增强immunobody载体pvaxdcib68(scib1)、pvaxdcib238(scib1plus)和pvaxdcib178(scib2),编码ch1-铰链-ch2-ch3结构域(登录号p01857氨基酸1-330)的抗体重链的huigg1恒定区在特定位点用编码取代的23个鼠igg3残基的相同区段取代。这通过合成两侧有afei和ecori的编码ch1-铰链-ch2-ch3 iv1的核苷酸区段来实现。使用这些限制性位点将huigg1恒定区从载体上切除,并将所述区段与重链可变区一起在框内插入。
[0364]
通过双脱氧链终止法[185]验证sn1-15的pvaxdc载体、pvaxdcib68 iv1、
pvaxdcib238 iv1和pvaxdcib178 iv1的每个表达盒内两条链的序列。图2至15、27和29、31和33分别显示了质粒sn1-sn15和增强的immunobody载体pvaxdcib68 iv1、pvaxdcib238 iv1和pvaxdcib178 iv1中编码的两条链的dna核苷酸和翻译的蛋白序列。
[0365]
使用的编码来自sars-cov2氨基酸1-1273(登录号yp_009724390/qhd43416.1)的全长刺突蛋白的质粒pcmv3-2019-ncov-刺突(s1+s2)-长获自sino biological(目录号vg40589-ut)。其含有密码子优化的cdna,用于在高水平表达哺乳动物人增强巨细胞病毒立即早期(cmv)启动子的控制下,在哺乳动物细胞中表达插入哺乳动物表达载体pcmv3-未加标签(pcmv3-untagged)的kpni/xbai位点的蛋白。
[0366]
为了构建pvaxdcsn16-17(sn16-17),需要连续两轮克隆。合成编码刺突链的两个密码子优化核苷酸区段,所述刺突链包含人igh前导序列(mdwiwrilflvgaatgahs)和刺突糖蛋白rbd结构域319-541氨基酸(登录号yp_009724390),其中对于sn16,刺突糖蛋白rbd结构域319-541氨基酸包含来自kent变体/谱系b.1.1.7,uk-voc 202012/01的n501y突变,或对于sn17,刺突糖蛋白rbd结构域319-541氨基酸包含来自南非变体/谱系voc 501y.v2/b1.351的k417n、e484k和n501y突变,并且核苷酸区段分别在5'端和3'端两侧有bamhi和xhoi位点。在第一轮克隆中,将所述区段插入pvaxdcib68(scib1)质粒的bamhi/xhoi位点,直接取代第一表达盒中的scib1κ轻链,形成两个中间质粒。
[0367]
在第二轮克隆中,合成编码核蛋白链的两个密码子优化的核苷酸区段,所述核蛋白链包含人igh前导序列,与改进的变体铰链-ch2-ch3 iv1人igg1恒定结构域(其中23个氨基酸已用鼠igg3残基取代)在框内融合的全长核蛋白氨基酸2-419(登录号yp_009724397),其中对于sn16,全长核蛋白氨基酸2-419包含来自kent变体/谱系b.1.1.7,uk-voc 202012/01的d3l和s235f突变,或对于sn17,全长核蛋白氨基酸2-419包含来自南非变体/谱系voc 501y.v2/b1.351的t205i突变,且核苷酸区段的两侧有hindiii/psti。使用hindiii/psti将scib1重链huigg1从第一轮形成的中间质粒切除,并用第二表达盒中的核蛋白区段在适当的刺突区段旁边取代,得到sn16和sn17。
[0368]
sn16和sn17的pvaxdc载体的每个表达盒内两条链的序列通过双脱氧链终止法验证。sn16和sn17内编码的两条链的dna核苷酸和翻译的蛋白序列如图47和48所示。
[0369]
表4covid19构建体
[0370]
[0371]
[0372][0373]
动物和细胞系
[0374]
使用8至16周龄的c57bl/6j、balb/c(charles river)、hla-dr4小鼠(模型#4149,taconic)、hhdii/hla-dp4小鼠(em:02221,欧洲小鼠突变库(european mouse mutant archive))、hhdii小鼠(pasteur研究所)或hhdii/hla-dr1小鼠(pasteur研究所)。所有工作都在内政部(home office)批准的项目许可证下按伦理许可进行。在所有研究中,小鼠被随机分为不同的组且对研究人员未设盲。
[0375]
在具有l-谷氨酰胺(2mmol/l)和10%fcs以及合适抗生素的rpmi培养基1640中培养包括表达相关mhci和ii等位基因的b16黑色素瘤(先前描述于[140,183,186,187])在内的细胞,以维持质粒。如先前所述[188]繁殖hek293t人胚胎肾细胞(atcc crl1573)。在具有10%fbs(sigma)、2mm谷氨酰胺、20mm hepes缓冲液、100单位/ml青霉素、100mg/ml链霉素和10-5
m 2-巯基乙醇的rpmi-1640中培养鼠脾细胞。使用的细胞系由提供者验证无支原体(str分型),并且在十代之内使用。
[0376]
hek293瞬时转染
[0377]
使用expifectamine
tm 293转染试剂盒(gibco,lifetechnologies)瞬时转染expi293f
tm
细胞之后评估pdna构建体的分泌水平。简言之,用100μg dna转染hek293细胞悬液(100ml,2x106/ml),并在转染后第6天收获条件培养基。条件上清液通过0.22μm瓶顶过滤
器(merck millipore)过滤并加入叠氮化钠至0.2%(w/v)的终浓度。根据制造商的说明,在适当体积的ripa缓冲液(sigma aldrich,r0278)中裂解细胞团粒,在分析之前通过离心澄清。
[0378]
免疫方案
[0379]
除非另有说明,小鼠在第1、8和15天或第1、5和29天利用1μg dna通过基因枪进行皮内免疫,并分别在第21或35天分析应答。
[0380]
为了进行肿瘤治疗研究,小鼠在第1天皮下植入2.5x104个b16f1或b16 hhdii nyeso1肿瘤细胞,随后在第4、11和18天或第4、8和11天接种。以3-4天的间隔测量肿瘤。小鼠的肿瘤生长通过利用卡尺测量肿瘤尺寸(长度和宽度)进行分析。通过下式估计体积:
[0381]
体积=(π/6)x(宽度x长度2)
[0382]
假病毒中和测定
[0383]
产生并克隆sars-cov-2刺突蛋白质粒,并按[189]所述用于丙型肝炎病毒的方法形成假颗粒。在没有质粒的情况下所形成的假颗粒用作阴性对照。为了进行sars-cov-2假颗粒的感染和中和测定,在白色96孔组织培养板(corning)中每孔植入hek293t细胞并于37℃温育过夜。第二天,将sars-cov-2假颗粒与适量抗体混合,于37℃温育1小时,然后添加至细胞。于37℃温育72小时之后,每孔加入100μl bright-glo(promega)并温育2分钟,或将细胞用细胞裂解缓冲液(目录号e1500;promega)裂解并置于摇床15分钟。使用spectramax m3酶标仪(molecular devices)和softmax pro6软件(bright-glo方案),以相对光单位(rlu)测量荧光素酶活性,或者使用fluostar omega酶标仪(bmg labtech)和mars软件,在各孔中注入50μl荧光素酶底物并读数。在相同稀释度的抗-sars-cov-2 mab、测试动物血清、免疫前动物血清和非特异性igg存在下检测来测量sars-cov-2假颗粒的感染。每个样品一式二份或一式三份进行检测。中和活性报告为50%抑制稀释度(id
50
)值并通过非线性回归(graphpad prism 7版)来计算,使用下限和上限(0%和100%抑制)作为约束条件来辅助曲线拟合。
[0384]
活病毒中和测定
[0385]
sars-cov-2感染性病毒(cvr-gla-1)获自英国nibsc的国家艾滋病试剂中心(the national centre for aids reagents,nibsc,uk)。
[0386]
使用先前所述方法[190]进行活病毒中和测定,除了将790tcid
50
/ml的sars-cov-2病毒加入各血清稀释液。此外,对于相同的测定,将血清稀释直至1:81920。
[0387]
ace2结合抑制测定
[0388]
使用来自meso scale diagnostics llc的v-plex covid-19 ace2中和试剂盒研究疫苗引发的抗体阻断ace2与rbd或完整s蛋白结合的能力。根据制造商的说明,封闭包含来自谱系a(在武汉最初鉴定)和变体(b1.1.7、b1.351、p.1)sars-cov-2毒株的s1 rbd和完整s蛋白的v-plex sars-cov-2 panel 7多斑点板,随后用以1:100稀释的血清和带磺化标签的人ace2蛋白温育。比较了血清温育样品与含稀释液的孔(无抑制),结果表示为ace2结合的抑制百分比。
[0389]
rbd结合抑制测定(替代中和测定)
[0390]
使用购自genescript(usa)的试剂盒评估rbd结合抑制。简言之,将免疫动物的不同稀释度血清与重组带hrp标签的rbd蛋白混合。将混合物添加至用ace2受体预先包被的平
板,并使用tmb底物检测rbd结合。rbd结合抑制计算为阴性对照为0%时的比色信号损失。
[0391]
elispot测定
[0392]
根据制造商的说明(mabtech ab,nacka strand,瑞典),使用鼠ifnγ捕获和检测试剂进行elispot测定。简言之,除非另有说明,用抗-ifnγ抗体包被96-孔immobilin-p板的孔,一式四份孔用5x105个脾细胞接种并加入最终浓度为10μg/ml的合成肽,1μg/ml的重组蛋白或1μg/ml的肽库。板于37℃在5%co2气氛中温育40小时。温育后,通过生物素化抗-ifnγ抗体检测所捕获的ifnγ,并用链霉亲和素碱性磷酸酶和显色底物显影。使用自动酶标仪(cellular technologies ltd europe gmbh,aalen,德国)分析并计数斑点。使用效应功能相比肽浓度作图,功能亲合力计算为引起50%最大效应功能的浓度。
[0393]
抗s和n抗体的elisa
[0394]
商购n、s1和rbd蛋白(genescript,usa)在pbs中稀释并以0.5μg/孔于4℃过夜包被高蛋白结合96-孔板。清洗板并用酪蛋白封闭剂(thermo scientific ref:37528)以200μl/孔于室温封闭至少1小时,接着加入(以不同的稀释度)稀释于2%bsa的pbs中的鼠血清于室温温育1小时。清洗平板并用含2%bsa的pbs中的抗-小鼠ig hrp抗体(2步elisa)或抗-小鼠fc-生物素之后链霉亲和素-hrpo(3步elisa)于室温温育1小时。清洗加入的tmb底物后,用1n h2so4终止反应。商购获得的鼠igg n和s1特异性抗体(sino biological)用作对照(n+ve和s1+ve)。包括来自幼稚小鼠的血清作为阴性对照。于450nm波长读取吸光度。
[0395]
夹心elisa检测分泌的rbd和n蛋白
[0396]
在两种情况下都使用商购试剂盒/抗体对。根据供应商的说明,使用来自bioss的sars-cov-2 np elisa试剂盒(目录号bskv0001)检测条件培养基和细胞裂解液(转染后6天)中的np。根据试剂盒提供的np标准曲线定量。使用夹心elisa检测rbd(分泌的和细胞裂解液中的),夹心elisa由捕获抗体sars-cov-2刺突中和小鼠mab(sino biological,40591-mm43)与来自sars-cov-2 s蛋白rbd抗体对的hrpo-标记的检测抗体(epigentek a73682)的组合组成。捕获抗体以200ng/孔包被;检测抗体以1:1000的稀释度使用。
[0397]
通过fc-融合构建体spr分析cd64结合
[0398]
用biat200进行分析。在结合抗-his抗体的cm5芯片上捕获带his标签的cd64(acrobiosystems,fca-h52h1)。芯片包括4个流动池,其中3个用于捕获增加密度的cd64,第四个流动池为参比池。在50.0nm至0.78nm浓度范围内滴定fc-构建体,并以30ul/’的流速分别监测缔合和解离210s和700s。通过将数据拟合至1:1单价结合模型中推导出动力学参数。
[0399]
经修饰的fc(ifcv1)构建体的免疫原性分析
[0400]
由abzena(cambridge)ltd根据hta标准进行分析。pbmc分离自健康群体供体血沉棕黄层(经同意获自商业供应商)。使用淋巴细胞分离介质(corning,amsterdam,荷兰)通过密度离心分离细胞并使用cd8+rosettesep
tm
(stemcell technologies inc,london,uk)耗竭cd8+t细胞。通过histo spot sso hla分型(mc diagnostics,st.asaph,uk)鉴定hla-dr和hla-dq单倍型至4位数分辨率来表征供体。还测定了对新抗原klh(invitrogen,paisley,uk)的t细胞应答。然后将pbmc冷冻并保存于氮气相中直到需要。选择了多达50个供体的队列,覆盖77%的hla等位基因。将来自各供体的pbmc解冻,计数并使用台盼蓝(merck life science uk ltd,gillingham,uk)染料排除法评估活力。对于每个供体,将1ml增殖细胞原液加入24孔板的适当孔中建立大批量培养物。将1ml测试样品(itv1)加入pbmc中,使最终样
品浓度为0.3μm。对于每个供体,还包括重现性对照孔(与0.3μm klh温育的细胞)、临床基准对照孔(与5μm温育的细胞)、低免疫原性对照(与0.3μm温育的细胞)和仅培养基的孔。培养物于37℃和5%co2下温育总共8天。第5、6、7和8天,每个孔中的细胞使用电子移液管通过混合5x轻轻重悬,并将3x100μl等分试样转移至96孔圆底板的每个孔中。培养物用100μl培养基中的0.75μci[3h]-胸苷(perkinbeaconsfield,uk)脉冲并再温育18小时,然后使用tomtec mach iii细胞收获机收获到过滤垫(perkinbeaconsfield,uk)上。每个孔的cpm用1450 microbeta wallac trilux液体闪烁计数器(perkinbeaconsfield,uk)通过meltilex
tm
(perkinbeaconsfield,uk)闪烁计数以paralux低本底计数来测定。先前已经建立了si等于或大于1.9(si≥1.90)的经验阈值,诱导应答高于此阈值的样品被视为阳性。
[0401]
统计分析
[0402]
使用graphpad prism 7软件对针对核酸质粒的应答进行统计分析。elispot结果的比较分析视情况采用配对或非配对anova或学生t检验进行,并相应计算p值。使用graphpad prism软件,通过应用f检验或对数秩检验来评估亲合力曲线/存活率的比较。p《0.05被认为是统计上显著的。使用kruskal-wallis方差分析(anova)和dunn’s多重比较检验进行组间中和滴度(id
50
值)的统计分析和比较。数据分析不设盲。如上所述,p值《0.05时,差异被认为是统计上显著的,并且使用graphpad prism 8软件进行统计分析。
[0403]
临床前研究
[0404]
实施例1利用pdna瞬时转染的hek293的rbd蛋白和n蛋白分泌
[0405]
为了评估pdna构建体的转染效率,使用thermofisher的expi293系统利用pdna瞬时转染hek293细胞,并使用夹心elisa评估rbd蛋白和核蛋白在培养基中的蛋白分泌(图16)。该分析表明,对于rbd蛋白,包含rbd-fc融合体的构建体(sn3和sn7)产生最高的分泌;紧接着是未经修饰的rbd(sn4、sn5、sn8)。三聚体rbd(sn2、sn6、sn9、sn10、sn11)产生最低的分泌水平。包含未经修饰的np的构建体(sn3、sn4、sn7、sn8)的核蛋白分泌最高。由于与诱导中和抗体相比,后者靶标与t细胞应答更相关;较低的分泌水平(如,n fc融合蛋白所观测到的)导致更强的t细胞应答是期望的。
[0406]
实施例2通过基因枪向hhdii小鼠递送pdna对rbd和n蛋白(np)的t细胞应答
[0407]
通过基因枪施用pdna使hhdii小鼠免疫3周后,测量了对pvaxdc刺突rbd+np(sn8),pvaxdc刺突rbd v2三聚体+npfc(sn9),pvaxdc刺突rbd v3三聚体+npfc(sn10)和pvaxdc刺突rbd v2三聚体+npfc iv1(sn11)的t细胞应答。使用预测或先前鉴定的t细胞表位和完整s1蛋白,rbd重组蛋白和rbd肽库,测量对所有rbd构建体的ifnγelispot应答频率。所有四个构建体均显示对s1蛋白以及rbd肽库和rbd aa417-425肽的强应答,其中对rbd肽库和rbd aa417-425肽的应答在所有构建体中达到显著(图17a)。使用重叠肽库、重组n蛋白和鉴定的t细胞表位,测量对n抗原的应答频率。所有构建体均显示对重组n蛋白的强应答,但是仅sn10和sn11构建体显示对n aa138-147肽的显著应答(图17a)。
[0408]
另一项研究比较了通过基因枪施用pdna使hhdii小鼠免疫3周后,对pvaxdc刺突rbd+np(sn8),pvaxdc刺突rbd v3三聚体+npfc(sn10)和pvaxdc刺突rbd v2三聚体+npfc iv1(sn11)的应答。所有三个构建体均显示对s1蛋白以及rbd肽库的显著应答,但是仅sn11
免疫的小鼠显示对rbd aa417-425肽的显著应答(图17b)。对于n蛋白特异性应答,所有四个构建体均显示对n蛋白的强应答,但是仅用sn11免疫的小鼠显示对n 138-146肽的显著应答(图17b)。
[0409]
实施例3通过基因枪向hhdii/dr1小鼠递送pdna对rbd和n蛋白(np)的t细胞应答
[0410]
经由基因枪施用pdna使hhdii/dr1小鼠免疫3周后,测量对pvaxdc刺突rbd+np(sn8),pvaxdc刺突rbd v2三聚体+npfc(sn9),pvaxdc刺突rbd v3三聚体+npfc(sn10)和pvaxdc刺突rbd v2三聚体+npfc iv1(sn11)的t细胞应答。使用鉴定的t细胞表位(rbd aa417-425)、完整s1蛋白、完整rbd蛋白和rbd肽库,测量对所有rbd构建体的ifnγelispot应答频率。构建体sn8、sn9和sn10显示仅对完整s1蛋白显著应答,而sn11构建体对s1和rbd蛋白、rbd肽库和rbd aa417-425肽产生应答(图18)。使用重叠肽库、n蛋白和鉴定的t细胞表位(n aa138-147),测量对n抗原的应答频率。构建体sn10和sn11对完整n蛋白产生显著应答,但是仅构建体sn11对n aa138-147肽产生显著应答(图18)。
[0411]
实施例4包含npfc iv1的构建体对n蛋白产生更高频率应答
[0412]
为比较包含n抗原(sn8)、n连接至fc(sn9)或n连接至经修饰的iv1 fc(sn11)的构建体的t细胞应答,将数据组合并针对背景对照归一化。与sn8或sn9相比时,构建体sn11显示对n蛋白和n 138-147肽的应答显著增强(分别为**p《0.01和*p《0.05)(图19a和图19b)。有趣地,与sn8相比,构建体sn11对s1蛋白的应答频率也更高(*p《0.05);与sn8和sn9相比,构建体sn11对rbd蛋白的应答频率也更高(***p《0.001)(图19c和图19d)。
[0413]
实施例5通过基因枪向hhdii/dp4小鼠递送pdna对rbd和n蛋白的t细胞应答
[0414]
通过基因枪每两周一次施用pdna使hhdii/dp4小鼠免疫三次后,测量对pvaxdc刺突rbd三聚体+npfc(sn2),pvaxdc刺突rbd fc+np(sn3)和pvaxdc刺突rbd+np(sn4)的t细胞应答。使用预测和鉴定的t细胞表位、完整s1蛋白和rbd蛋白,测量对所有rbd蛋白构建体的ifnγelispot应答频率。观测到构建体sn2对rbd aa417-425肽、rbd蛋白和rbd肽库的显著应答,构建体sn4对s1和rbd蛋白的显著应答(图20)。使用n蛋白以及预测和鉴定的t细胞表位,测量对n构建体的elispot应答频率。构建体sn2和sn4显示对n蛋白的强应答(***p《0.001),但是sn3的应答未达到显著(图20)。
[0415]
实施例6rbd fc和rbd三聚体构建体通过基因枪递送pdna对s1蛋白的t细胞应答亲合力更优
[0416]
通过基因枪每两周一次施用pdna使hhdii/dp4小鼠免疫三次后,对pvaxdc刺突rbd三聚体+npfc(sn2),pvaxdc刺突rbd fc+np(sn3)和pvaxdc刺突rbd+np(sn4)的t细胞应答评估对s1蛋白滴定的亲合力。与用sn4免疫的小鼠相比,用sn2和sn3免疫的小鼠中的应答显示显著更高的应答亲合力(p《0.0001)(图21)。使用归一化数据将亲合力测量为引起50%最大应答的浓度。这相当于sn2为0.0001μg/ml,sn3为0.000008μg/ml,以及sn4为0.17μg/ml。
[0417]
实施例7pdna免疫产生对rbd 417-425表位的高亲合力肽特异性应答
[0418]
通过基因枪每周一次施用pdna使hhdii/dp4小鼠免疫三次后,对pvaxdc刺突rbd v2三聚体+npfc iv1(sn11)的t细胞应答通过肽滴定评估对rbd 417-425肽的亲合力。利用sn11免疫的小鼠中的应答显示大于0.0001ug/ml的高亲合力应答(图22)。
[0419]
实施例8npfc iv1构建体通过基因枪递送pdna对n 138-146肽的t细胞应答频率和亲合力更优
[0420]
通过基因枪每周一次施用pdna使hhdii/dp4小鼠免疫三次后,对pvaxdc刺突rbd v3三聚体+npfc(sn10)、pvaxdc刺突rbd v2三聚体+npfc iv1(sn11)的t细胞应答通过肽滴定评估对n 138-146肽的亲合力。与利用sn10免疫的小鼠相比,利用sn11免疫的小鼠中的应答显示更高频率以及稍微更高的应答亲合力(图23)。表明与npfc构建体(sn10)相比,np fc iv1构建体(sn11)诱导更高频率和亲合力的t细胞。
[0421]
实施例9通过基因枪递送pdna对rbd和n蛋白的抗体应答
[0422]
通过基因枪每两周一次施用pdna使hhdii/dp4小鼠免疫三次后,测量对pvaxdc刺突rbd+npfc(sn5)、pvaxdc刺突rbd三聚体+npfc(sn6)、pvaxdc刺突rbd v2三聚体+npfc(sn9)、pvaxdc刺突rbd v3三聚体+npfc(sn10)、pvaxdc刺突rbd v2三聚体+npfc iv1(sn11)或pvaxdc刺突rbd三聚体+npfc(sn2)、pvaxdc刺突rbd fc+np(sn3)和pvaxdc刺突rbd+np(sn4)的抗体应答。比较了利用单体rbd构建体、以fc融合蛋白呈现的二聚体rbd、以次要纤维蛋白构建体呈现的作为三聚体的rbd构建体和作为三聚体的较短rbd免疫的小鼠血清对s1、rbd和n蛋白的抗体(ab)滴度。在1/100至1/10,000稀释度下的血清中评估抗体。所有免疫小鼠的血清中均观测到对n蛋白的强烈反应性,即使在1/10,000稀释度下也是如此(图24)。在1/100和1/1000稀释度下的血清中观测到对s1和rbd蛋白的反应性,并且来自包含作为单体(sn5)或三聚体(sn6)的较长rbd构建体以及较短rbd v3三聚体(sn10)的构建体sn5、sn6和sn10对s1和rbd蛋白的反应性是最高的(图24a)。在sn2、sn3和sn4免疫的小鼠血清中检测到对s1和n蛋白的类似抗体应答(图24b)。
[0423]
通过基因枪每周一次施用pdna使hhdii/dp4小鼠免疫三次后,在elisa测定中测量对pvaxdc刺突rbd fc+np(sn3)、pvaxdc刺突rbd+np(sn8)、pvaxdc刺突rbd v3三聚体+npfc(sn10)和pvaxdc刺突rbd v2三聚体+npfc iv1(sn11)的抗体应答。在1/100至1/10,000稀释度下的血清中评估抗体。在所有免疫的小鼠血清中均观测到对n蛋白的强反应性,即使在1/10,000稀释度下也是如此。在1/100和1/1000稀释度下的血清中观测到对s1蛋白的反应性,并且来自包含较短rbd v3三聚体(sn10)的构建体sn10对s1蛋白的反应性是最高的,但是在1/1000稀释度下的来自包含全长rbd单体的构建体sn8的血清中也可检测到(图24c)。
[0424]
实施例10通过基因枪递送的pdna引起与总抗体测量值相似滴度的病毒中和抗体应答
[0425]
在替代中和测定中评估病毒中和抗体对rbd与结合ace2受体的板的结合的抑制。利用分别包含较长rbd单体,较长rbd三聚体或较短rbd v3三聚体的构建体sn5、sn6和sn10免疫的小鼠血清在1/100稀释度下显示》50%抑制,并且构建体sn9和sn11观测到更低滴度(图25)。同样在假病毒中和测定中测试血清样品的病毒中和。sn2、sn3和sn4免疫小鼠的血清在仅两次免疫之后在第21天时进行评估,而对于sn5、sn6、sn9、sn10和sn11血清在结束时(第35天)进行评估。在该测定中,仅用构建体sn3、sn5和sn6免疫的小鼠血清在1/100稀释度下显示》50%病毒中和,其中在1/100稀释度下sn5显示接近90%中和且sn3接近80%中和(图26a)。针对无关病毒未观测到病毒中和(图26b)。来自包含np、npfc和npfc iv1的构建体观测到针对n蛋白的强抗体滴度。包含rbd单体或以fc融合体呈现的rbd二聚体的构建体显示靶向s蛋白的最高抗体滴度以及与总ig抗体滴度相似的最高病毒中和抗体。
[0426]
在假病毒中和测定中,还分析了不同血清稀释度下的病毒中和(图26c)。滴定数据显示,用构建体sn5免疫的小鼠血清在1/3517的血清稀释度下显示50%中和滴度(id50)。用
构建体sn6免疫的小鼠在1/236稀释度下的滴度和用构建体sn3免疫的小鼠在1/600稀释度下的滴度(图26d)。
[0427]
表5covid19构建体的总结
[0428][0429][0430]
表6对covid-19构建体的免疫应答总结m单体,fc fc-融合,fcv1 fc-融合增强的,t三聚体,sm小单体,st小三聚体,cc-额外半胱氨酸
[0431][0432]
所有covid-19构建体均包含作为单体、三聚体或fc融合蛋白的s蛋白rbd,以及作为单体、fc融合蛋白或经修饰允许在细胞表面抗原-fc融合蛋白非共价缔合的fc融合蛋白
的n蛋白(表5和表6)。
[0433]
sn11表达融合至经修饰的fc的n蛋白,相比融合至未经修饰的fc的n蛋白或单独的n蛋白,sn11对n蛋白和对hla-a2表位n 138-146产生明显更好的t细胞应答。更有趣地是,相比表达同一rbd构建体但无n-fc的类似构建体,该构建体对rbd、s1和肽rbd 417-425产生更强的应答。这表明经修饰的n-fc起类似佐剂的作用并使apc活化同时增强对其他抗原的t细胞应答。
[0434]
相比之下,针对rbd单体(sn1、sn4、sn5、sn8、sn15),rbd三聚体(sn2、sn6、sn9、sn11、sn12)和rbd-fc(sn3、sn7、sn13、sn14)刺激了最好vnab。产生构建体比较了rbd三聚体与rbd-fc和rbd-增强的fc与fc修饰的n蛋白的组合。包含rbd单体和n蛋白分别融合至增强的fc区(sn15)、或rbd和n蛋白分别融合至增强的fc区(sn14)的构建体产生最强的抗体和t细胞应答。
[0435]
以上实施例显示了这样的疫苗,其合并了刺突蛋白的rbd来刺激中和抗体和t细胞应答,还合并了n蛋白来诱导记忆t细胞应答,不仅可针对covid19而且还可针对任何新出现的冠状病毒提供保护,因为n蛋白高度保守且很少突变。
[0436]
实施例11编码fc修饰的huigg1构建体的cdr内的t细胞表位的pdna(iscib1)产生强t细胞应答
[0437]
通过基因枪利用编码scib1(wo2008/116937
–
图28)或iscib1(图29)的pdna免疫常规c57bl/6或hla转基因小鼠(hla-dr4)并通过ifnγelispot测定评估免疫应答,将二者进行比较。图34a显示在免疫的c57bl/6和hla-dr4小鼠中scib1和iscib1 dna都产生了高频率trp2 180-188应答。通过肽滴定分析应答亲合力显示,在c57bl/6和hla-dr4小鼠中,相比scib1 dna免疫,iscib1 dna免疫产生更高亲合力trp2 180-188特异性cd8应答(图35b和图35c)。还分析了hla-dr4小鼠对gp100 44-59表位的应答频率,表明利用iscib1dna免疫的小鼠趋向于更高频率的应答(图34d)。
[0438]
实施例12编码fc修饰的huigg1构建体的cdr内的t细胞表位的pdna(iscib1plus)产生强t细胞应答
[0439]
通过基因枪利用编码scib1plus(图30)或iscib1plus(图31)的pdna免疫hla转基因小鼠(hla-dr4,c57bl/6或hhdii/dp4)并通过ifnγelispot测定评估免疫应答,将二者进行比较。图35a显示在免疫的c57bl/6、hhdii、hhdii/dp4和hla-dr4小鼠中scib1plus和iscib1plus dna都产生了高频率trp2 180-188应答。通过肽滴定分析应答亲合力显示,在c57bl/6和hla-dr4小鼠中,相比scib1plus dna免疫,iscib1plus dna免疫产生更高亲合力trp2 180-188特异性cd8应答(图35b和图35c)。hla-dr4小鼠中gp100 44-59特异性应答频率分析表明,利用iscib1plus dna免疫的小鼠趋向于更高频率的应答(图35d)。
[0440]
实施例13编码fc修饰的huigg1构建体的cdr内的t细胞表位的pdna(iscib1和iscib1plus)介导有效的肿瘤治疗
[0441]
常规c57bl/6或hla转基因小鼠(hhdii/dp4)植入表达适当mhc等位基因的b16黑色素瘤细胞,之后分别利用编码scib1(图28)、iscib1(图29)、scib1plus(图30)或iscib1plus(图31)的pdna免疫,并分别将scib1(图28)与iscib1(图29)进行比较,或将scib1plus(图30)与iscib1plus(图31)进行比较。监测肿瘤生长和存活率。c57bl/6小鼠的肿瘤治疗研究示于图36中。利用iscib1 dna免疫的小鼠显示比利用scib1 dna免疫的小鼠更慢的肿瘤生
长和比对照小鼠显著更慢的肿瘤生长(p=0.0012)(图36a)。利用scib1plus dna或iscib1plus dna免疫的小鼠显示比对照显著更慢的肿瘤生长(p《0.0001)(图36b)。第18天的肿瘤体积分析表明,与scib1plus dna相比,利用iscib1plus dna免疫的小鼠导致更慢的肿瘤生长(图36b)。与对照小鼠相比,iscib1、scib1plus和iscib1plus dna免疫的小鼠显示显著提高的总存活率(分别为p=0.0143,p=0.0143和p《0.0001)(图36c)。尽管利用scib1plus和iscib1plus免疫提供了肿瘤治疗,但是与scib1plus dna相比,iscib1plus dna免疫显示显著提高的总存活率(p=0.0003)(图36c)。
[0442]
实施例14编码fc修饰的huigg1构建体的cdr内的t细胞表位的pdna(iscib2)产生强t细胞应答
[0443]
通过基因枪利用编码scib2(图32)或iscib2(图33)的pdna免疫hla转基因小鼠(hhdii或hhdii/dr1)并通过ifnγelispot测定评估免疫应答,将二者进行比较。图37a显示在免疫的hhdii和hhdii/dr1小鼠中scib2和iscib2 dna都产生了高频率nyeso1 157-165应答。通过肽滴定分析应答亲合力显示,hhdii小鼠中scib2和iscib2 dna免疫都产生了高亲合力nyeso1 157-165特异性cd8应答,但是在hhdii/dr1小鼠中iscib2产生比scib2更高的亲合力(图37b和图37c)。nyeso 119-143序列包含已知的hla-dr1表位,因此在hhdii/dr1小鼠中分析对nyeso 119-143表位的应答。与scib2相比,这些显示来自iscib2的应答频率显著增强(p=0.0338)(图37d)。亲合力分析显示,在hhdii/dr1小鼠中,由iscib2产生的nyeso 119-143应答也具有比由scib2产生的应答更高的亲和力(p=0.0363)(图37e)。
[0444]
实施例15编码fc修饰的huigg1构建体的cdr内的t细胞表位的pdna(iscib2)介导有效的肿瘤治疗
[0445]
hla转基因小鼠(hhdii)植入表达适当mhcl等位基因的b16黑色素瘤细胞,之后通过基因枪利用编码scib2(图32)或iscib2(图33)的pdna进行免疫,将二者进行比较。监测肿瘤生长和存活率。利用scib2和iscib2免疫的小鼠都显示比对照小鼠显著提高的无肿瘤存活率(分别为p《0.0001和p=0.0010),而scib2和iscib2免疫的小鼠之间没有显著差异(图38)。
[0446]
实施例16来自通过基因枪递送的pdna的covid-19特异性t细胞和中和抗体应答,rbd fc iv1构建体优于rbd fc构建体
[0447]
balb/c和hla-a2转基因小鼠利用包含n蛋白融合至经修饰的fc(npfc iv1)以及rbd结构域融合至fc(rbd fc,sn13,图14)或rbd结构域融合至经修饰的fc(rbd fc iv1,sn14,图15)的pdna进行免疫。通过ifnγelispot测定评估t细胞应答,与rbd fc,sn13(图39a)相比,利用rbd fc iv1,sn14免疫的小鼠显示对来自rbd蛋白的重叠肽库显著更高频率的应答。分析hla-a2转基因小鼠对来自rbd(rbd 417-425)的hla-a2表位的应答亲合力表明,sn14(rbd fc iv1)免疫的小鼠比利用sn13(rbd fc)免疫的小鼠产生更高的亲合力应答(图39b)。
[0448]
通过elisa评估免疫的balb/c小鼠的抗体应答,sn13和sn14免疫的小鼠显示类似的s1蛋白特异性抗体滴度(图39c)。在假病毒中和测定中分析中和抗体应答时,与利用sn13(rbd fc)免疫的小鼠血清相比,利用sn14(rbd fc iv1)免疫的小鼠血清显示更高的中和id50滴度(图39d)。该数据为来自包含抗原融合至经修饰的fc的pdna构建体的优异t细胞和中和抗体应答提供了证据。
[0449]
实施例17利用sn11、12、13、14和15pdna瞬时转染hek293的rbd蛋白和n蛋白分泌
[0450]
为了评估sn11、12、13、14和15pdna构建体与sn5 pdna相比的转染效率,使用thermofisher's expi293系统利用pdna瞬时转染hek293细胞,并使用夹心elisa评估培养基和细胞裂解物中rbd蛋白和核蛋白的蛋白分泌(图40)。该分析表明,对于rbd蛋白,包含rbd-fc融合蛋白的构建体(sn13)产生最高的分泌;紧接着是未经修饰的rbd单体(sn5和sn15)和连接至经修饰的fc的rbd单体(sn14)(图40a)。在细胞裂解物中,未经修饰的rbd单体以及核蛋白连接至经修饰fc(sn15)显示出最高的rbd蛋白水平(图40a)。对于构建体(sn11、12、13、14和15),裂解物中的核蛋白是类似的,但是在包含rbd三聚体(sn12)和rbd单体(sn15)的构建体中分泌的蛋白水平略高(图40b)。
[0451]
实施例18通过基因枪递送的sn15 pdna的covid-19特异性中和抗体应答优于来自完整s pdna的应答
[0452]
利用包含n蛋白融合至经修饰的fc(npfc iv1)以及rbd单体(sn15)、rbd三聚体(sn12)或rbd单体连接至fc(sn13)的pdna或利用完整s pdna,免疫balb/c和c57b1/6小鼠。通过elisa评估免疫的balb/c小鼠的抗体应答,与完整s dna或sn11免疫的小鼠相比,sn15和sn13显示s1蛋白特异性的抗体和总igg的滴度更高(图41a)。在假病毒中和测定中分析中和抗体应答时,与利用sn12(rbd三聚体和npfciv1)或sn13(rbd fc和npfciv1)免疫的小鼠血清相比,利用sn15(rbd单体和npfciv1)免疫的小鼠血清显示更高的中和id50滴度(图41b)。在假病毒中和测定中比较了利用sn15或完整s pdna免疫的c57bl/6小鼠的抗体应答,与完整s pdna相比,利用sn15 pdna免疫的小鼠显示更高的中和滴度(图41c)。这表明在两种小鼠模型中,sn15 pdna免疫后获得了更优的中和抗体。
[0453]
实施例19来自经由基因枪递送的sn15 pdna的covid-19特异性t细胞应答优于来自完整s pdna的应答
[0454]
利用包含n蛋白融合至经修饰的fc(npfc iv1)以及rbd单体(sn15),rbd三聚体(sn12),rbd短三聚体(sn11)或rbd单体连接至fc(sn13)的pdna或利用完整s pdna,免疫balb/c、hla-a2转基因和c57b1/6小鼠。通过ifnγelispot测定评估免疫小鼠的t细胞应答,显示利用sn15、sn13、sn12和sn11 pdna免疫的小鼠对来自rbd蛋白的重叠肽库的高频率应答(图42ai)。sn15、sn11和sn12免疫小鼠的应答显著高于来自sn13免疫小鼠的应答(p《0.0001)。在分析hla-a2转基因小鼠中的肽特异性应答时,观测到类似的应答模式(p=0.0002)(图42aii)。利用sn15 pdna免疫的balb/c和c57b1/6小鼠与利用完整s pdna免疫的小鼠进行比较,显示利用sn15免疫的小鼠对来自rbd蛋白的重叠肽库显著增强的应答(p=0.0002)(图42b)。该数据为sn15 pdna构建体的t细胞应答优于编码完整s蛋白的构建体的应答提供了证据。
[0455]
实施例20fc修饰的huigg1构建体显示比未经修饰的fc更强的cd64结合
[0456]
通过增强的抗原内化以及改进的apc活化的组合,使抗原靶向高亲和力fcγr1(cd64)诱导更好的体液和t细胞应答。与未经修饰的rbd-fc构建体相比,具有经修饰的fc的纯化的rbd构建体显示与cd64的长期相互作用,这种现象在较高cd64受体密度下更明显,表明增加的亲合力(图43,实时spr结合曲线)。从表7中的动力学参数中可明显看出这一点,其中与未经修饰的fc构建体相比,经修饰的fc在较高的cd64密度(300和900ru)下观测到更慢的解离(与rbd-fc的kd为10-3
1/s相比,rbd-ifcv1的kd约为10-4
1/s)和更高的最大结合
(rmax)。
[0457]
表7包含fc的构建体的相互作用的动力学常数(bia t200)
[0458][0459]
实施例21在20个供体的组中经修饰的ifcv1构建体无免疫原性
[0460]
理论上,经修饰的fc(ifcv1)中残基变化的存在具有在临床上施用于人志愿者时诱导免疫原性的能力。因此,这在由abzena(uk)进行的研究中进行了评估,其中使用曲妥珠单抗(trastuzumab)作为比较物。为了评估ifcv1融合构建体是否具有在人中诱导cd4 t细胞应答的潜力(这是免疫原性的重要驱动因素),创建了包含经修饰的ifcv1的曲妥珠单抗构建体“itv1”。在增殖测定(3h-胸苷摄入法)中,使用来自代表欧洲和北美人群的20个供体的组(覆盖约77%的hla等位基因)的cd8耗竭的外周血单核细胞(pbmc)评估免疫原性itv1。在与itv1或野生型曲妥珠单抗和对照温育后的第5-8天评估t细胞应答(图44a)。经修饰的fc构建体itv1在3/20供体中产生了略有增加的增殖;这与abzena的低免疫原性对照观测到的结果(在2/20供体中观测到增殖略有增加)相当。二者的刺激指数均为2至2.5,远低于利用阳性对照klh或所观测到的刺激指数,后者已知在45%的患者中诱导抗药物抗体。cd8耗竭的pbmc的最大增殖应答的比较显示itv1和之间没有显著差异(图44b),表明与sn15类似,itv1中的fc修饰不太可能在人中刺激有效cd4 t细胞应答。
[0461]
实施例22在50个供体的组中经修饰的ifcv1构建体无免疫原性
[0462]
除了在20个供体的组中进行研究之外,进行重复以扩展至跨越更广泛的hla类型的50个供体的组。经修饰的fc构建体itv1在3/50供体中的增殖略有增加;这同样与利用abzena的低免疫原性对照观测到的结果(在2/20供体中观测到增殖略有增加,且在1/50供体中观测到较大增加)相当(图45a)。对于itv1,观测到2至2.4的刺激指数,远低于利用阳性对照klh或所观测到的刺激指数,后者已知在45%的患者中诱导抗药物抗体。cd8耗竭的pbmc的最大增殖应答的比较显示itv1和之间没有显著差异(图45b),表明与sn15、sn17、iscib1、iscib1plus和iscib2类似,itv1中的fc修饰不太可能在人中刺激有效cd4 t细胞应答。
[0463]
实施例23通过基因枪递送的编码np、np fc和np fciv1的pdna引起covid-19n蛋白特异性抗体应答
[0464]
通过elisa分析利用编码np、np fc或np fciv1的pdna免疫的小鼠血清对sars-cov-2n蛋白的抗体反应性。无论是否与fc融合,所有构建体中均观测到相似的抗体应答和ec
50
值(图45)。
[0465]
实施例24通过sn15 pdna进行疫苗接种诱导与变异株交叉反应的抗体应答
[0466]
利用包含n蛋白融合至经修饰的fc(npfc iv1)以及rbd单体(sn15)的pdna免疫balb/c小鼠,并通过elisa评估血清对来自武汉(谱系a),b.1.351和b.1.1.7病毒株的变体s1蛋白的抗体应答。观测到对来自谱系a,b.1.1.7和b.1.351变体的s1蛋白特异性抗体滴度较高,在低至1/100,000的血清稀释度下相比背景具有可检测的应答。对谱系a和b.1.1.7变体s1蛋白的反应性未观测到显著差异(图49)。观测到对b.1.351变体的ec
50
降低,但该数据表明对b.1.1.7和b.1.351变体的交叉反应性抗体应答的诱导。
[0467]
实施例25通过sn15、sn16和sn17 pdna疫苗接种诱导与变异株交叉反应的抗体应答同时抑制ace2结合
[0468]
利用包含rbd单体(sn15),来自b.1.1.7变体的rbd单体(sn16,图47)或来自b.1.351变体的rbd单体(sn17,图48)(均融合至经修饰的fc的相关变体n蛋白(npfc iv1))的pdna免疫balb/c小鼠。通过elisa评估血清对来自武汉(谱系a)、b.1.351和b.1.1.7病毒株的变体s1蛋白的抗体应答。从对来自谱系a、b.1.1.7和b.1.351变体s1蛋白特异的sn17和sn16中观测到高滴度的抗体,在低至1/100,000的血清稀释度下相比背景具有可检测的应答。从sn17未观测到谱系a、b.1.351和b.1.1.7变体s1蛋白的反应性有显著差异(图50ai)。从sn16(图50aii)观测到与sn15(图49)类似的应答。观测到对b.1.351变体的ec
50
降低(图50aiii),但尽管如此,该数据表明诱导了对b.1.1.7和b.1.351变体的交叉反应性抗体应答。来自利用谱系a和b.1.351变体疫苗构建体免疫的小鼠血清与来自利用完整s dna免疫的小鼠血清进行比较,显示对谱系a s1蛋白和b.1.351s1蛋白均有更高的滴度应答(图50b)。
[0469]
使用mesoscale discovery平台评估免疫小鼠血清抑制ace2受体与变体rbd或完整s蛋白结合的能力。与利用nibsc 20/136对照(图50ci)相比,利用原始谱系a疫苗构建体(sn15)和b.1.351变体疫苗构建体(sn17)进行疫苗接种的小鼠血清对rbd与ace2结合的抑制作用更高。相比之下,利用完整s dna免疫的小鼠血清显示抑制ace2结合的能力更低,这与nibsc 20/136对照相似。利用原始谱系a疫苗构建体(sn15)免疫的小鼠血清抑制80-100%的ace2与原始谱系a rbd和b.1.1.7变体的结合,其中针对b.1.351和p.1rbd变体下降至50-60%。在利用b.1.351变体疫苗(sn17)免疫的小鼠血清中观测到相反的结果。尽管对ace2结合b.1.351和p.1rbd变体的抑制降低,但抑制水平仍然高于使用完整s dna免疫小鼠血清所观测到的水平。在ace2受体结合抑制测定中,利用变体完整s蛋白观测到类似趋势(图50cii)。
[0470]
实施例26在假型和活病毒中和测定中sn15和sn17免疫小鼠血清显示病毒中和
[0471]
还在针对原始谱系a和b.1.351变体的假型和活病毒中和测定中评估了利用原始谱系a(sn15)或b.1.351(sn17)变体疫苗免疫的balb/c小鼠血清。来自原始变体疫苗免疫小鼠的血清显示有效中和原始谱系a假型,其中针对b.1.351变体疫苗的效力降低(id
50
值分别为6232和2137)(图51a)。利用任一疫苗免疫的小鼠血清显示中和b.1.351假型变体,但是注意到差异很小(id
50
值分别为948和997)。在活病毒中和测定中,利用原始谱系a(sn15)或b.1.351(sn17)变体疫苗免疫的小鼠血清中和原始谱系a病毒的id
50
值分别为4964和1334,并且二者均优于nibsc对照(图51b)。
[0472]
实施例27t细胞应答不受病毒株变异的影响
[0473]
为了检测t细胞应答是否受到不同病毒变体的突变的影响,利用原始谱系a疫苗(sn15)或b.1.351疫苗(sn17)免疫的小鼠脾细胞用源自原始序列的rbd和n肽库离体刺激。检测对rbd和n特异的t细胞应答,由不同疫苗构建体诱导的应答之间差异很小(图52)。这些结果表明,b.1.351变体的突变对t细胞应答的影响较小。
[0474]
实施例28抗体应答可通过对变异株特异的疫苗有效地加强并显示对b.1.351和b.1.617.2变体的交叉反应性
[0475]
为了检测利用sn15疫苗针对谱系a病毒引起的抗体应答是否可通过靶向b.1.351变体的疫苗(sn17)加强,第1天和第29天利用sn15疫苗免疫balb/c小鼠,之后第85天利用sn17疫苗加强。通过elisa检测第42、82和98天采集的血清样品对谱系a和b.1.351s1蛋白反应性的抗体应答。作为比较,仅用sn17疫苗免疫小鼠。在两组血清中,在低至1/100,000的稀释度下可检测到抗体应答(图53a)。在两组小鼠中,与第42天相比,第82天观测到应答滴度下降,但是针对谱系a s1蛋白,ec
50
值保持》1/3500。在两组小鼠中,第85天利用sn17疫苗加强针均有效地加强第98天对谱系a s1蛋白的应答,表明sn17疫苗有效加强由sn15和sn17疫苗初免的应答。与谱系a s1蛋白相比,两组小鼠中对b.1.351s1蛋白的反应性均降低,具有较低的ec
50
值,并且这在利用sn15+sn17加强免疫的小鼠中更明显。尽管如此,具有sn17疫苗的加强针能够将sn15疫苗初免组中的应答提高到在接受sn17初免的小鼠中观测到的类似水平。
[0476]
通过elisa分析利用这些初免加强方案免疫的小鼠血清对来自b.1.351和b.1.617.2变体的rbd蛋白的反应性(图53b)。与b.1.351s1蛋白相比,来自两组小鼠的血清对b.1.351rbd蛋白显示更高的抗体滴度和ec
50
值。同样,与第82天相比,显示第98天利用sn15或sn17初免的小鼠对b.1.351rbd蛋白的应答通过sn17加强针有效加强。在利用sn17疫苗初免的小鼠中注意到加强针疫苗之后的较高滴度。第82天,对来自b.1.617.2变体的rbd蛋白的交叉反应性分析显示高滴度应答,其中利用sn15初免的小鼠ec
50
值为8355,利用sn17初免的小鼠ec
50
值为5738。这比同一血清中对b.1.351rbd蛋白观测到的反应性更高,表明两种疫苗对这种变体具有良好的交叉反应性。利用sn17疫苗的加强针在两组小鼠中导致滴度和ec
50
值增加至相似水平,表明sn17加强针可加强由sn15和sn17疫苗初免诱导的b.1.617.2变体交叉反应性rbd特异性应答。
[0477]
参考文献
[0478]
1.ichim,c.v.,revisiting immunosurveillance and immunostimulation:implications for cancer immunotherapy.j transl med,2005.3(1):p.8.
[0479]
2.burnet,f.m.,the concept of immunological surveillance.prog exp tumor res,1970.13:p.1-27.
[0480]
3.swann,j.b.and m.j.smyth,immune surveillance of tumors.j clin invest,2007.117(5):p.1137-46.
[0481]
4.shankaran,v.,et al.,ifngamma and lymphocytes prevent primary tumour development and shape tumour immunogenicity.nature,2001.410(6832):p.1107-11.
[0482]
5.ferradini,l.,et al.,analysis of t cell receptor variability in tumor-infiltrating lymphocytes from a human regressive melanoma.evidence for in situ t cell clonal expansion.j clin invest,1993.91(3):p.1183-90.
[0483]
6.zorn,e.and t.hercend,a natural cytotoxic t cell response in a spontaneously regressing human melanoma targets a neoantigen resultingfrom a somatic point mutation.eur j immunol,1999.29(2):p.592-601.
[0484]
7.schreiber,r.d.,l.j.old,and m.j.smyth,cancer immunoediting:integrating immunity'sroles in cancer suppression and promotion.science,2011.331(6024):p.1565-70.
[0485]
8.driessens,g.,j.kline,and t.f.gajewski,costimulatory and coinhibitory receptors in anti-tumor immunity.immunol rev,2009.229(1):p.126-44.
[0486]
9.capece,d.,et al.,targeting costimulatory molecules to improve antitumor immunity.jbiomed biotechnol,2012.2012:p.926321.
[0487]
10.abdelmoula,m.,et al.,igg3 is the major source of cryoglobulins in mice.j immunol,1989.143(2):p.526-32.
[0488]
11.cooper,l.j.,et al.,h chain c domains influence the strength of binding of igg for streptococcal group a carbohydrate.j immunol,1991.146(8):p.2659-63.
[0489]
12.greenspan,n.s.,d.a.dacek,and l.j.cooper,cooperative binding of two antibodies to independent antigens by an fc-dependent mechanism.faseb j,1989.3(10):p.2203-7.
[0490]
13.grey,h.m.,j.w.hirst,and m.cohn,a new mouse immunoglobulin:igg3.j exp med,1971.133(2):p.289-304.
[0491]
14.greenspan,n.s.,w.j.monafo,and j.m.davie,interaction of igg3 anti-streptococcal group a carbohydrate(gac)antibody with streptococcal group a vaccine:enhancing and inhibiting effects of anti-gac,anti-isotypic,and anti-idiotypic antibodies.j immunol,1987.138(1):p.285-92.
[0492]
15.greenspan,n.s.and l.j.cooper,cooperative binding by mouse igg3 antibodies:implications for functional亲和力,effector function,and isotype restriction.springer semin immunopathol,1993.15(2-3):p.275-91.
[0493]
16.greenspan,n.s.and l.j.cooper,intermolecular cooperativity:a clue to why mice have igg3?immunol today,1992.13(5):p.164-8.
[0494]
17.lefranc,m.p.,et al.,imgt,the international immunogenetics information system.nucleic acids res,2009.37(database issue):p.d1006-12.
[0495]
18.cui,j.,f.li,and z.l.shi,origin and evolution of pathogenic coronaviruses.nat rev microbiol,2019.17(3):p.181-192.
[0496]
19.lefkowitz,e.j.,et al.,virus taxonomy:the database of the international committee on taxonomy of viruses(ictv).nucleic acids res,2018.46(d1):p.d708-d717.
[0497]
20.fehr,a.r.and s.perlman,coronaviruses:an overview of their replication and pathogenesis.methods mol biol,2015.1282:p.1-23.
coronavirus assembly and morphology.j struct biol,2011.174(1):p.11-22.
[0530]
53.dediego,m.l.,et al.,a severe acute respiratory syndrome coronavirus that lacks the e gene is attenuated in vitro and in vivo.j virol,2007.81(4):p.1701-13.
[0531]
54.nieto-torres,j.l.,et al.,severe acute respiratory syndrome coronavirus envelope protein ion channel activity promotes virus fitness and pathogenesis.plos pathog,2014.10(5):p.e1004077.
[0532]
55.chang,c.k.,et al.,modular organization of sars coronavirus nucleocapsid protein.j biomed sci,2006.13(1):p.59-72.
[0533]
56.hurst,k.r.,c.a.koetzner,and p.s.masters,identification of in vivo-interacting domains of the murine coronavirus nucleocapsid protein.j virol,2009.83(14):p.7221-34.
[0534]
57.chen,y.,et al.,structure analysis of the receptor binding of 2019-ncov.biochem biophys res commun,2020.
[0535]
58.wrapp,d.,et al.,cryo-em structure of the 2019-ncov spike in the prefusion conformation.science,2020.367(6483):p.1260-1263.
[0536]
59.coutard,b.,et al.,the spike glycoprotein of the new coronavirus 2019-ncov contains a furin-like cleavage site absent in cov of the same clade.antiviral res,2020.176:p.104742.
[0537]
60.xu,z.,et al.,pathological findings of covid-19 associated with acute respiratory distresssyndrome.lancet respir med,2020.8(4):p.420-422.
[0538]
61.li,t.,et al.,significant changes of peripheral t lymphocyte subsets in patients with severeacute respiratory syndrome.j infect dis,2004.189(4):p.648-51.
[0539]
62.mahallawi,w.h.,et al.,mers-cov infection in humans is associated with a pro-inflammatory th1 and th17 cytokine profile.cytokine,2018.104:p.8-13.
[0540]
63.channappanavar,r.and s.perlman,pathogenic human coronavirus infections:causes andconsequences of cytokine storm and immunopathology.semin immunopathol,2017.39(5):p.529-539.
[0541]
64.kindler,e.,v.thiel,and f.weber,interaction of sars and mers coronaviruses with theantiviral interferon response.adv virus res,2016.96:p.219-243.
[0542]
65.wu,f.,et al.,a new coronavirus associated with human respiratory disease in china.nature,2020.579(7798):p.265-269.
[0543]
66.wang,f.,et al.,characteristics of peripheral lymphocyte subset alteration in covid-19pneumonia.j infect dis,2020.
[0544]
67.shokri,s.,et al.,modulation of the immune response by middle east respiratory syndromecoronavirus.j cell physiol,2019.234(3):p.2143-2151.
in recovered sars patients.clin immunol,2006.120(2):p.171-8.
[0559]
82.ng,o.w.,et al.,memory t cell responses targeting the sars coronavirus persist up to 11years post-infection.vaccine,2016.34(17):p.2008-14.
[0560]
83.ahmed,s.f.,a.a.quadeer,and m.r.mckay,preliminary identification of potentialvaccine targets for the covid-19 coronavirus(sars-cov-2)based on sars-cov immunologicalstudies.viruses,2020.12(3).
[0561]
84.grifoni,a.,et al.,a sequence homology and bioinformatic approach can predictcandidate targets for immune responses to sars-cov-2.cell host microbe,2020.27(4):p.671-680 e2.
[0562]
85.bhattacharya,m.,et al.,development of epitope-based peptide vaccine against novelcoronavirus 2019(sars-cov-2):immunoinformatics approach.j med virol,2020.
[0563]
86.nguyen,a.,et al.,human leukocyte antigen susceptibility map for sars-cov-2.j virol,2020.
[0564]
87.grifoni,a.,et al.,targets of t cell responses to sars-cov-2 coronavirus in humans withcovid-19 disease and unexposed individuals.cell,2020.
[0565]
88.tang,f.,et al.,lack of peripheral memory b cell responses in recovered patients with severeacute respiratory syndrome:a six-year follow-up study.j immunol,2011.186(12):p.7264-8.
[0566]
89.xu,x.and x.gao,immunological responses against sars-coronavirus infection in humans.cell mol immunol,2004.1(2):p.119-22.
[0567]
90.thevarajan,i.,et al.,breadth of concomitant immune responses prior to patient recovery:acase report of non-severe covid-19.nat med,2020.26(4):p.453-455.
[0568]
91.koutsakos,m.,et al.,circulating tfh cells,serological memory,and tissuecompartmentalization shape human influenza-specific b cell immunity.sci transl med,2018.10(428).
[0569]
92.long,q.x.,et al.,antibody responses to sars-cov-2 in patients with covid-19.nat med,2020.
[0570]
93.ferretti,a.p.,et al.,unbiased screens show cd8(+)t cells of covid-19 patientsrecognize shared epitopes in sars-cov-2 that largely reside outside the spike protein.immunity,2020.53(5):p.1095-1107.e3.
[0571]
94.qu,j.,et al.,profile of igg and igm antibodies against severe acute respiratory syndromecoronavirus 2(sars-cov-2).clin infect dis,2020.
[0572]
95.liu,l.,et al.,anti-spike igg causes severe acute lung injury by skewing macrophageresponses during acute sars-cov infection.jci insight,2019.4(4).
fitness model predicts tumor response to checkpoint blockade immunotherapy.nature,in press.
[0602]
125.bassani-sternberg,m.,et al.,direct identification of clinically relevant neoepitopes presented on native human melanoma tissue by mass spectrometry.nat commun,2016.7:p.13404.
[0603]
126.carreno,b.m.,et al.,cancer immunotherapy.a dendritic cell vaccine increases the breadth and diversity of melanoma neoantigen-specific t cells.science,2015.348(6236):p.803-8.
[0604]
127.sahin,u.,et al.,personalized rna mutanome vaccines mobilize poly-specific therapeutic immunity against cancer.nature,2017.547(7662):p.222-226.
[0605]
128.ott,p.a.,et al.,an immunogenic personal neoantigen vaccine for patients with melanoma.nature,2017.547(7662):p.217-221.
[0606]
129.kreiter,s.,et al.,mutant mhc class ii epitopes drive therapeutic immune responses to cancer.nature,2015.520(7549):p.692-6.
[0607]
130.verdegaal,e.m.,et al.,neoantigen landscape dynamics during human melanoma-t cell interactions.nature,2016.536(7614):p.91-5.
[0608]
131.boon,t.and p.van der bruggen,human tumor antigens recognized by t lymphocytes.jexp med,1996.183(3):p.725-9.
[0609]
132.khong,h.t.and s.a.rosenberg,pre-existing immunity to tyrosinase-related protein(trp)-2,a new trp-2isoform,and the ny-eso-1melanoma antigen in a patient with a dramatic response to immunotherapy.j immunol,2002.168(2):p.951-6.
[0610]
133.gnjatic,s.,et al.,ny-eso-1dna vaccine induces t-cell responses that are suppressed by regulatory t cells.clin cancer res,2009.15(6):p.2130-9.
[0611]
134.jiang,j.,et al.,fusion of hsp70 to mage-a1 enhances the potency of vaccine-specific immune responses.j transl med,2013.11:p.300.
[0612]
135.dowling,j.k.and a.mansell,toll-like receptors:the swiss army knife of immunity and vaccine development.clin transl immunology,2016.5(5):p.e85.
[0613]
136.zom,g.g.,et al.,two in one:improving synthetic long peptide vaccines by combining antigen and adjuvant in one molecule.oncoimmunology,2014.3(7):p.e947892.
[0614]
137.zom,g.g.,et al.,tlr2 ligand-synthetic long peptide conjugates effectively stimulate tumor-draining lymph node t cells of cervical cancer patients.oncotarget,2016.7(41):p.67087-67100.
[0615]
138.cho,h.i.,et al.,bivax:a peptide/poly-ic subunit vaccine that mimics an acute infection elicits vast and effective anti-tumor cd8 t-cell responses.cancer immunol immunother,2013.62(4):p.787-99.
compendium of methods from current protocols in molecular biology.2nd ed.1992:brooklyn,ny:green pub.associates:new york,ny:wiley.
[0660]
183.xue,w.,et al.,scib2,an antibody dna vaccine encoding ny-eso-1epitopes,induces potent antitumor immunity which is further enhanced by checkpoint blockade.oncoimmunology,2016.5(6):p.e1169353.
[0661]
184.jurtz,v.,et al.,netmhcpan-4.0:improved peptide-mhc class i interaction predictions integrating eluted ligand and peptide binding亲和力data.j immunol,2017.199(9):p.3360-3368.
[0662]
185.sanger,f.,s.nicklen,and a.r.coulson,dna sequencing with chain-terminating inhibitors.proc natl acad sci u s a,1977.74(12):p.5463-7.
[0663]
186.brentville,v.a.,et al.,citrullinated vimentin presented on mhc-ii in tumor cells is atarget for cd4+t-cell-mediated antitumor immunity.cancer res,2016.76(3):p.548-60.
[0664]
187.brentville,v.a.,et al.,t cell repertoire to citrullinated self-peptides in healthy humans is not confined to the hla-dr se alleles;targeting of citrullinated self-peptides presented by hla-dp4 for tumour therapy.oncoimmunology,2019.8(5):p.e1576490.
[0665]
188.clayton,r.f.,et al.,analysis of antigenicity and topology of e2 glycoprotein present on recombinant hepatitis c virus-like particles.j virol,2002.76(15):p.7672-82.
[0666]
189.pestka,j.m.,et al.,rapid induction of virus-neutralizing antibodies and viral clearance in a single-source outbreak of hepatitis c.proc natl acad sci u s a,2007.104(14):p.6025-30.
[0667]
190.coleman,c.m.,et al.,purified coronavirus spike protein nanoparticles induce coronavirusneutralizing antibodies in mice.vaccine,2014.32(26):p.3169-3174.
网址:编码包含人IgG1的经修饰的Fc区和至少一种异源抗原的多肽的核酸的制作方法 https://mxgxt.com/news/view/684468
相关内容
国产美容肽的30年追赶史:从模仿向创新转型樊文花对抗衰老型肌肤新突破,60万花粉最爱的抗衰明星出炉
姜黄素及其代谢修饰产物对PC12细胞氧化损伤的保护作用
植物乳杆菌KLDS1.0391 PurR和PurL蛋白的原核表达、纯化及其与细菌素合成启动子的相互作用
李嘉诚投资的NMN究竟是什么?海参肽又是什么?
《食品科学》:花生主要过敏原Ara h 1线性B细胞表位的预测及鉴定
一种玉米油精炼工艺的制作方法
一种用于平面连续定位的QRL码及其连续定位的方法与流程
黑松露的功效与作用
硬核是什么意思 硬核的来源和含义

