《Cancer Discovery》
过去10年,以PD-1/PD-L1和CTLA-4抑制剂为首的免疫检查点疗法(Immune checkpoint therapy ,ICT)在临床上取得了巨大的突破,包括肺癌、胃癌、结直肠癌、黑色素瘤等在内的多种癌症的晚期患者的生存情况都得到了一定的改善。
2011年,美国食品药品监督管理局(FDA)批准了首款免疫检查点靶向药物Ipilimumab上市,正式拉开了ICT的历史大幕;随后PD-1/PD-L1免疫检查点抑制剂的获批,在肿瘤治疗中掀起了新的浪潮。2011年~2021年,ICT提供了靶向T细胞的临床治疗的理解和实践。
接下来10年,ICT疗法该走向何方?
国际顶级期刊《Cancer Discovery》上刊登了“免疫检查点抑制剂的下一个10年”的文章。
让我们一起看看在未来十年里,ICT如何在肿瘤治疗中发挥更好的治疗作用。
缘起:T细胞的激活与抑制
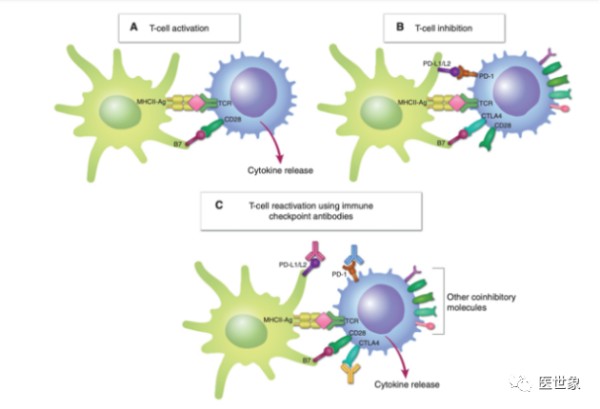
T细胞是特异性免疫的主要战士之一,T细胞激活主要涉及2个信号的协同过程。
第一个过程是T细胞上的T细胞受体(TCR)识别抗原递呈细胞(APC)上的MHC(CD3信号通路);
第二个过程是给T细胞一个共刺激信号(CD28共刺激信号通路)。
这两个过程的协同完成才会促使T细胞被激活,开始分化和扩增,并进一步形成记忆T细胞,形成长期的免疫记忆。
T细胞活化过程
T细胞可以分为2个主要的亚群,包括CD4+ T细胞和CD8+ T细胞。其中,CD4+ T细胞还可以进一步细分为Th1、Th2、Th17、滤泡性Th (Tfh)、调节性 T细胞 (Treg) 和Th9细胞,这些不同的细胞亚群有着不同的转录因子,可以调节T细胞群体的功能和细胞因子谱。
目前来说,Th1 CD4+ T细胞和CD8+ T细胞是负责驱动抗肿瘤反应的效应细胞,但是T细胞也有对应的反馈调节历程:当TCR和CD28通路都被激活T细胞开始增殖并产生细胞因子时,细胞内和细胞外也会有多种抑制机制启动,以控制T细胞反应避免其过度活跃伤害正常细胞。
而随着临床研究的深入,人们发现在这个过程中,抑制T细胞活性的通路可能被癌细胞劫持,从而降低T细胞的杀伤作用,并最终推动癌细胞发展和转移。
CTLA-4介导的T细胞抑制效应
在T细胞内,CTLA-4就是一个典型的抑制分子,当TCR参与识别后CTLA-4就会开始表达,并在T细胞激活后的48~72小时左右达到顶峰,其可以和共刺激信号CD28信号通路产生竞争性抑制,从而抑制T细胞信号传导抑制T细胞活性。
PD-1介导的T细胞抑制效应
PD-1同样是一个抑制分子,其主要生物学活性是为了避免T细胞激活后对周围正常细胞产生错误杀伤作用。在T细胞的反应过程中,PD-1可以和PD-L1和PD-L2相结合,从而在非淋巴组织中广泛表达,抑制外周T细胞活化。
在早期的临床研究中,发现阻止CTLA-4通路可以延长T细胞反应时间并消灭癌细胞,而且可以介导T细胞浸润肿瘤组织,导致肿瘤消退和生存期延长;而PD-L1则被发现在多种肿瘤模型中高表达,阻断这一路径同样也可以有效地提升T细胞的杀伤作用,并介导肿瘤消退。
由此可见,尽管CTLA-4和PD-1介导的T细胞反应的机制并不相同,但是均可以提升T细胞的肿瘤杀伤作用。由于激活路径不同,CTLA-4免疫检查点抑制剂也可以和PD-1/PD-L1抑制剂结合使用,进而提升肿瘤治疗效果,这种组合策略已经广泛应用于临床。
正当时:ICT获批疗法
自2011年第一款ICT疗法获批上市以来,第一个10年内,FDA已经批准ICT用于多达50种癌症治疗。



第一个10年内获得FDA批准上市用于治疗的免疫检查点抑制剂疗法.
值得注意的是:由于接受ICT后可能会出现特殊的“假性进展”现象,即患者治疗后一段时间发现肿瘤增大但是随着时间延长肿瘤逐渐消退的现象,因此一些传统的肿瘤测量指标无法充分ICT的治疗效果,人们需要以总生存时间来评估ICT的治疗效果:实际上,大约有20%的患者在接受Ipilimumab治疗后获得了超过3年的长期生存,而且部分患者的生存期可以超过10年。
不过,目前来说Ipilimumab仍旧是唯一获得批准的抗CTLA-4疗法,其他的药物仍在开发中。和CTLA-4 相比,PD-1/PD-L1免疫检查点抑制剂在第一个十年有了较为长足的进展。
2014年,PD-1抑制剂首次获批用于治疗不可切除或转移性黑色素瘤患者,此后短短几年间,PD-1/PD-L1抑制剂已经获批用于肺癌、皮肤癌、泌尿生殖系统癌、肺癌、头颈癌、乳腺癌、淋巴瘤、妇科癌和胃肠道癌等多种癌症。
由于肿瘤存在一些共性特征,比如高微卫星不稳定性 (MSI-H)、错配修复缺陷 (dMMR)以及高肿瘤突变负荷 (TMB-high)等,PD-1/PD-L1抑制剂获批用于这些具有共性的癌症,不论具体是哪一种癌症,这也是泛癌种治疗的基础。
尽管ICT单一疗法已经有着良好的反应,但是单药使用的总体反应率只有20%~30%。因此在临床实践中,人们开始将目光转向ICT免疫联合疗法。在黑色素瘤、肝细胞癌、肾细胞癌、非小细胞肺癌、恶性胸膜间皮瘤和结直肠癌等多种癌症治疗中,都发现CTLA-4抑制剂和PD-1/PD-L1抑制剂联合使用可以提升患者的治疗效果,并在后续的长期随访中发现可以延长患者的生存期。
除此之外,免疫联合化疗已经被证实可以提升非小细胞肺癌、小细胞肺癌、三阴性乳腺癌、膀胱癌和头颈部鳞状细胞癌患者的生存期,不过目前还需进一步研究化疗对于ICT疗法的影响机制。此外,ICT联合靶向药治疗也可以改善患者的临床反应:VEGF靶向药联合PD-1抑制剂可以提升子宫内膜癌、肝细胞癌和黑色素瘤的治疗效果。
尽管这些联合疗法可以改善患者的治疗效果,但是这些结果仍旧局限在特定的肿瘤类型,目前也在积极探索多种ICT联合疗法,以更好地提升治疗效果。积极探索有效的ICT联合疗法是下一个十年探索的重要方向,另一个大方向则是如何找到那些接受治疗可以发挥良好效果的人群。
下一步:如何找到最适合的治疗人群
ICT 领域的主要挑战之一是缺乏用于最佳患者选择的预测生物标志物。
传统上,生物标志物主要集中在肿瘤内在因素或单一免疫特异性标志物上;但是随着我们对抗肿瘤免疫决定因素的理解不断加深,单一的生物标志物可能并不足以确认最佳治疗人群。
因此,人们开始根据肿瘤的影响因素、免疫特殊因素来共同寻找哪些可以预测治疗结果的组合,这一策略也得到了临床治疗的验证。
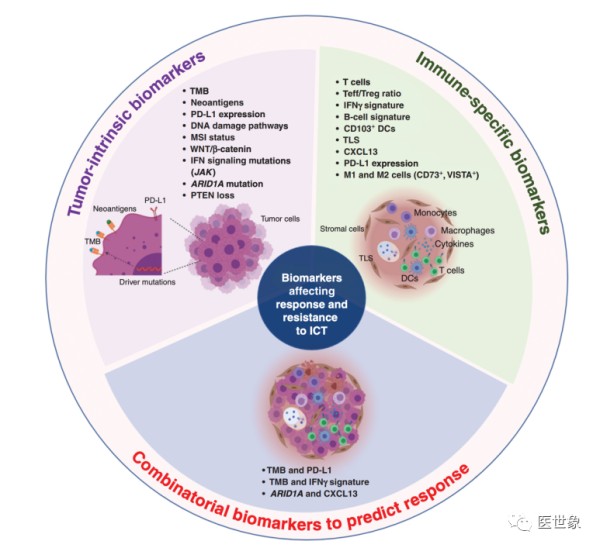
对ICT治疗有反应或者抵抗的生物标志物图鉴,通过对生物标志物进行不同的组合从而预测患者接受治疗后的效果.
近期有研究显示:多种生物标志物的组合可能比单一生物标志物更好地预测患者治疗效果。在一项针对1000多名接受ICT治疗的7种不同肿瘤类型的癌症患者的分析结果中发现,组合的生物标志物指标优于单个的生物标志物指标,可以更好预测患者接受治疗后的生存情况。
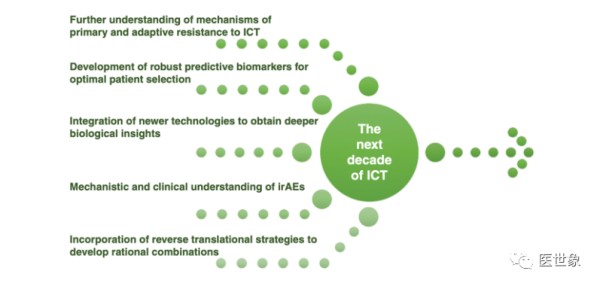
下一个十年ICT进展的5个重要领域,包括:
1. 进一步了解ICT的原发性和适应性免疫治疗机制;
2. 寻找合适的生物标志物以优化患者选择;
3. 整合多项新技术以加深ICT疗法的生物学了解;
4. ICT治疗副作用机制和临床理解;
5. 寻找合理的ICT疗法组合。
总体而言,下一个十年,癌症免疫治疗领域需要纵向发展,深入了解不同的免疫细胞亚群及其调节反应机制,同时也需要横向发展,同癌症生物学、表观遗传学和计算生物学相结合;另外,ICT还需要扩展到所有的肿瘤学领域,包括和手术、放疗、化疗、靶向治疗以及免疫治疗药物联合使用,从而更好地提升患者接受治疗后的效果。
相信在下一个十年,ICT将成为继续、手术、放化疗以靶向药治疗之后的癌症治疗的又一个基石,进一步改善癌症患者的预后。
参考资料: Sharma P, Siddiqui BA, Anandhan S, et al. The Next Decade of Immune Checkpoint Therapy. Cancer Discov. 2021 Apr;11(4):838-857. doi: 10.1158/2159-8290.CD-20-1680. PMID: 33811120.
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界([email protected])处理。
网址:《Cancer Discovery》 https://mxgxt.com/news/view/357037
相关内容
Gemini and Cancer Compatibility: Can Gemini’s Logic Balance Cancer’s Emotions?2024年纳米、能源、催化最新“影响因子”!
吕海泉
朱莉公开信畅谈乳腺手术:我的医疗选择
李明星 副研究员 (硕士生导师)
Search Results For “”
Discovery与胡军品牌发布会举行
黄晓明联手设计师张帅创立男装品牌M
英孚少儿英语老师教你怎么用英语聊星座
Starbase数据库使用

